题目内容
下列叙述中,正确的是
A.含金属元素的离子一定都是阳离子
B.现代化学分析测试中,常借助一些仪器来分析化学物质组成。例如,可用元素分析仪确定C、H、O等元素,用红外光谱仪确定物质中的有机原子团,用原子吸收光谱确定物质中含有哪些非金属元素
C.某元素从化合态变为游离态时,该元素一定被还原
D.金属阳离子被还原不一定得到金属单质
D
解析试题分析:A、部分含金属元素的离子为阴离子,如MnO4?、AlO2?等,错误;B、原子吸收光谱也可以确定物质含有的金属元素,错误;C、某元素从化合态变为游离态,若化合态时为正价被还原,若化合态时为负极被氧化,错误;D、如Fe3+离子可被弱还原剂还原为Fe2+,正确。
考点:本题考查元素的检验、化学反应规律。

某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系如图所示,则原溶液中Fe(NO3)3、 Cu(NO3)2、HNO3物质的量浓度之比为
| A.1∶1∶1 | B.3∶3∶8 | C.1∶3∶1 | D.1∶1∶4 |
某化学小组用下图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是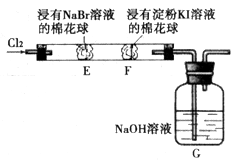
A.E处棉花球变成黄色,说明 的氧化性比 的氧化性比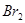 强 强 |
B.F处棉花球变成蓝色,说明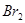 的氧化性比 的氧化性比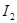 强 强 |
C.E处发生反应的离子方程式为: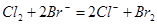 |
D.G装置中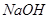 溶液与 溶液与 反应的离子方程式为: 反应的离子方程式为: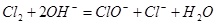 |
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+aOH-=Y+S4O62-+2H2O
下列说法中,不正确的是 ( )
| A.S2O32-是还原剂 | B.Y的化学式为Fe2O3 |
| C.a=4 | D.每有1molO2参加反应,转移的电子总数为4mol |
多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1︰13,则x的值是
| A.5 | B.4 | C.3 | D.2 |
下列说法不正确的是( )
| A.等质量的乙烯和丙烯中含有的共用电子对数目相等 |
| B.等质量14NO和13C0气体中含有的中子数相等 |
| C.10. 6 g Na2CO3固体中含阴阳离子总数约为1.806 x 1023 |
| D.5.6 g铁和6. 4 g铜分别与0.1mol氯气完全反应,转移的电子数相等 |
下列说法正确的是( )
| A.NO2溶于水时,被氧化的n(NO2)与被还原的n(NO2)之比为3:1 |
| B.Na2CO3溶液中c(Na+)与c(CO32ˉ )之比为2:1 |
| C.0.2mol/L与0.1mol/L醋酸中c(H+)之比为2:1 |
| D.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是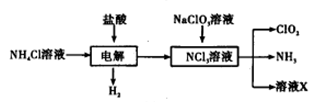
A.电解时发生反应的化学方程式为: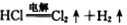 |
| B.由NaClO3溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的成分为NaClO3和NaOH |