题目内容
13.在高温时,水蒸气与灼热的还原铁粉发生反应的方程式为:3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.其中,水中H元素化合价降低,得电子;铁作为还原剂,被氧化.当消耗0.3mol铁时,反应中共转移0.8NANA个电子,生成的氢气体积约为8.96(标态下) L.分析 氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂被氧化,根据铁和转移电子之间的关系式计算转移电子数,根据铁和氢气之间的关系式计算氢气的体积.
解答 解:该反应中,氢元素的化合价由+1价→0价,所以水中氢元素得电子化合价降低,水是氧化剂;铁元素的化合价由0→+2、+3价,铁失电子化合价升高,所以铁是还原剂,
设转移电子数是x,生成氢气的体积是y,
3Fe+4H2O(g) $\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 转移电子
3mol 89.6L 8NA
0.3mol y x
x=$\frac{0.3mol×8{N}_{A}}{3mol}$=0.8NA,y=$\frac{89.6L×0.3mol}{3mol}$=8.96L,
故答案为:H;还原;0.8NA;8.96.
点评 本题考查氧化还原反应中的有关计算,明确元素化合价是解本题的关键,注意四氧化三铁中铁元素的化合价,为易错点.

练习册系列答案
 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
4.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 在常温常压下,11.2LN2含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol H2O含有的质子数为NA | |
| C. | 1.00molNaCl中,所有Na+的最外层电子总数为8NA | |
| D. | 23g钠在化学反应中失去电子数目为10 NA |
1.向Fe(OH)3胶体中逐滴加入一种液体,首先发生凝聚而沉淀,然后继续加入时沉淀又消失.这种加入的液体可能是下列物质中的( )
| A. | 0.05mol•L-1的H2SO4溶液 | B. | 0.05mol•L-1的MgSO4溶液 | ||
| C. | 0.05mol•L-1的KCl溶液 | D. | 蒸馏水 |
8.在潜水艇中和防毒面具中也用来消除CO2的是( )
| A. | Na2CO3 | B. | NaOH | C. | Na2O | D. | Na2O2 |
18.下列物质中化学式错误的是( )
| A. | 氦气(He2) | B. | 氢气(H2) | C. | 氯化铝(AlCl3) | D. | 甲烷(CH4) |
5.下列应用或事实与胶体的性质没有关系的是( )
| A. | 在河流入海口处易形成三角州 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 尿毒症患者做“血液透析” | |
| D. | 在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 |
2.关于有机物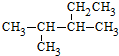 的系统命名正确的是( )
的系统命名正确的是( )
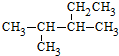 的系统命名正确的是( )
的系统命名正确的是( )| A. | 2-甲基-3-乙基丁烷 | B. | 3-甲基-2-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 3,4-二甲基戊烷 |
3.人体内存在着酸碱平衡,如出现失衡将对人体健康产生极大危害.人体内生成的下列酸属于无机物的是( )
| A. | 乳酸(C3H6O3) | B. | 磷酸(H3PO4) | C. | 丙酮酸(C3H4O3) | D. | 乙酰乙酸(C4H6O3) |