题目内容
16. 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子最外层电子数是次外层电子数的3倍.E有“生物金属”之称,E4+和氩原子的核外电子排布相同.请回答下列问题:
(1)B、C、D三种元素的电负性由小到大的顺序为C<N<O,E的基态原子的电子排布式为[Ar]3d24s2或1s22s22p63s23p63d24s2.
(2)由B、D形成的BD32-离子中,其VSEPR模型名称是平面三角形,离子的中心原子采用sp2杂化.
(3)已知由A、C、D三种元素按照4:2:3的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度为10-5mol/L.
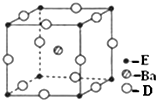
(4)D、E和钡三种元素构成的某化合物的晶胞结构如图所示,该化合物的化学式为BaTiO3.
(5)纳米级的EO2是一种广泛使用的催化剂,实验室往往通过ECl4在大量水中加热水解制得EO2•xH2O,该反应的化学方程式为TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O+4HCl.
分析 A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为C元素;
A位于周期表的s区,其原子中电子层数和未成对电子数相同,A的原子序数小于B,则A是H元素;
D原子最外层电子数是次外层电子数的3倍,则D是O元素;
C元素原子序数大于B而小于D,所以C是N元素;
E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E是Ti元素,
(1)同一周期元素,元素电负性随着原子序数增大而增大;
E是Ti元素,根据构造原理书写Ti的基态原子的电子排布式;
(2)由C、O形成的CO32-离子中,根据价层电子对互斥理论判断VSEPR模型名称及中心原子杂化方式;
(3)由H、N、O三种元素按照4:2:3的原子个数比可形成某离子化合物为NH4NO3,硝酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度=10-pH;
(4)O、Ti和钡三种元素构成的某化合物,根据均摊法确定该化合物的化学式;
(5)纳米级的TiO2是一种广泛使用的催化剂,实验室往往通过TiCl4在大量水中加热水解制得TiO2•xH2O,根据反应物、生成物及反应条件书写方程式.
解答 解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期,B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为C元素;
A位于周期表的s区,其原子中电子层数和未成对电子数相同,A的原子序数小于B,则A是H元素;
D原子最外层电子数是次外层电子数的3倍,则D是O元素;
C元素原子序数大于B而小于D,所以C是N元素;
E有“生物金属”之称,E4+和氩原子的核外电子排布相同,则E是Ti元素,
(1)同一周期元素,元素电负性随着原子序数增大而增大,所以这三种元素电负性C<N<O;
E是Ti元素,根据构造原理知Ti的基态原子的电子排布式为[Ar]3d24s2或1s22s22p63s23p63d24s2,
故答案为:C<N<O;[Ar]3d24s2或1s22s22p63s23p63d24s2;
(2)由C、O形成的CO32-离子中,根据价层电子对互斥理论知,该离子中价层电子对个数是3且不含孤电子对,所以VSEPR模型名称是平面三角形,中心原子杂化方式为sp2,
故答案为:平面三角形;sp2;
(3)由H、N、O三种元素按照4:2:3的原子个数比可形成某离子化合物为NH4NO3,硝酸铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,常温下测得该离子化合物的水溶液pH=5,则该溶液中水电离出的氢离子浓度=10-pHmol/L=10-5mol/L,
故答案为:10-5mol/L;
(4)D是O元素,E是Ti元素,O、Ti和钡三种元素构成的某化合物,根据均摊法知,Ba原子个数是1,O原子个数=12×$\frac{1}{4}$=3,Ti原子个数=8×$\frac{1}{8}$=1,所以其化学式为BaTiO3,
故答案为:BaTiO3;
(5)纳米级的TiO2是一种广泛使用的催化剂,实验室往往通过TiCl4在大量水中加热水解制得TiO2•xH2O,根据反应物、生成物及反应条件知该反应方程式为TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O+4HCl,
故答案为:TiCl4+(x+2)H2O$\stackrel{△}{?}$TiO2•xH2O+4HCl.
点评 本题考查位置结构性质的相互关系及应用,涉及晶胞计算、盐类水解、原子杂化方式判断、电负性、等知识点,这些都是高考高频点,明确价层电子对互斥理论、构造原理、均摊法、盐类水解原理即可解答,难点是晶胞计算,题目难度中等.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 在醋酸溶液中加入少量NaHSO4固体,醋酸的电离平衡左移,且溶液中的c(H+)减小 | |
| B. | 将纯水加热到100℃,测得PH<7,说明升高温度可使水呈酸性 | |
| C. | 0.2mol/L的盐酸与水等体积混合,所得溶液的PH=1 | |
| D. | PH=3的稀硫酸与PH=11的氨水等体积混合,所得溶液的PH=7 |
| A. | 98g H2SO4 | B. | 1NA个CO2 | C. | 44.8LHCl | D. | 6gH2 |
| A. | 盐酸→SO3→石墨→Na2CO3•10H2O | B. | NaCl→NH3→铜→空气 | ||
| C. | 蔗糖→CuSO4→N2→Fe(OH)3胶体 | D. | KCl→CaO→液氯→石灰水 |
| A. | 乙烯的最简式(实验式)为:C2H4 | B. | 乙醇的结构简式为:C2H6O | ||
| C. | 醛基的简写方式为:-CHO | D. | 苯分子中既有单键又有双键 |
 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1②N2(g)+3H2(g)≒2NH3(g)△H2=-92.4kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ•mol-1
下列说法正确的是( )
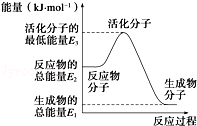
| A. | 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1mol N2和3mol H2,反应后放出的热量为Q1 kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
| A. | 上述反应若有0.9molBr2反应,转移电子为1.5×6.02×1023个 | |
| B. | 反应后溶液的PH增大 | |
| C. | 若将NaBr和NaBrO3转变为Br2,需要在碱性条件下进行 | |
| D. | 该反应Na2CO3既是氧化剂又是还原剂 |
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液.
| A. | ①②④ | B. | ①③⑤ | C. | ②③ | D. | ②④⑤ |
| A. | SiO2和NO2能与强碱溶液反应,都是酸性氧化物 | |
| B. | 不锈钢材料因含有铬、镍所以抗腐蚀性好 | |
| C. | 普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐 | |
| D. | MgO和A12O3熔点较高都可以做耐火材料,都能和强碱溶液反应 |