题目内容
11. 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$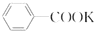 +KOH+2MnO2+H2O
+KOH+2MnO2+H2O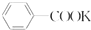 +HCl→
+HCl→ +KCl
+KCl已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g•cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g.
【制备产品】
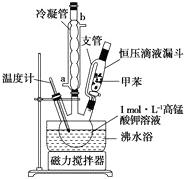
30.0mL甲苯和25.0mL 1mol•L-1高锰酸钾溶液在80℃下反应30min,装置如图所示:
(1)图中支管的作用是平衡压强,使甲苯顺利滴入三颈烧瓶.
(2)在本实验中,三颈烧瓶最合适的容积是B(填字母)
A.50mL B.100mL C.200mL D.250mL
【分离产品】
他们设计如下流程分离粗产品苯甲酸和回收甲苯:
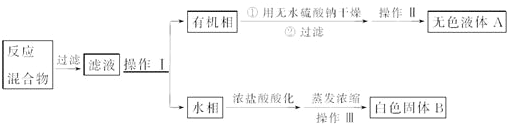
(3)操作Ⅰ的名称是分液;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是蒸馏.
(4)操作Ⅲ的名称是冷却结晶、过滤.检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的AgNO3溶液,若产生白色沉淀,则B中含有Cl-.
分析 (1)支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等;
(2)本实验中用到的液体体积约为55mL,据此选择三颈烧瓶的规格;
反应混合物过滤得到滤液通过分液得到有机相和水相,有机相中用无水硫酸钠干燥,蒸馏过滤得到无色液体A,水相加入浓盐酸酸化,蒸发浓缩冷却结晶过滤洗涤得到白色固体B,
(3)依据流程分析混合物分离的实验方法和操作步骤;
(4)结合反应化学方程式中生成的产物和流程中分离步骤分析,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与KCl的混合物,先检验苯甲酸的检验再检验氯化钾的存在,利用硝酸酸化的硝酸银检验氯离子的存在.
解答 解:(1)支管连接了恒压滴液漏斗中的液体上、下方,使恒压滴液漏斗中的液体上、下方的压强相等,便于甲苯顺利滴入三颈烧瓶,
故答案为:平衡压强,便于甲苯顺利滴入三颈烧瓶;
(2)本实验中用到的液体体积约为55mL,所以选择100mL的三颈烧瓶,故选B,
故答案为:B;
(3)一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按流程分离出苯甲酸和回收未反应的甲苯;所以操作Ⅰ是分离出有机相甲苯,用分液方法得到;操作Ⅱ是蒸馏的方法控制甲苯沸点得到纯净的甲苯液体,
故答案为:分液;蒸馏;
(4)操作Ⅲ的名称是冷却结晶、过滤得到白色固体B,通过测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,推测白色固体B是苯甲酸与KCl的混合物,氯化钾可以用硝酸酸化的硝酸银溶液检验氯离子的存在,滴入适量的硝酸酸化的AgNO3溶液,若产生白色沉淀,则B中含有Cl-.
故答案为:冷却结晶、过滤;AgNO3.
点评 本题考查了物质性质的实验原理的分析判断,物质分离条件,试剂选择,操作步骤的理解应用,物质成分的实验设计方案、步骤、试剂,样品纯度的计算,题目难度中等.

| A. | CH3CH2COOCH(CH3)2 | B. | CH3CH2COOCH2CH=CH2 | ||
| C. | (CH3)2CHCOOCH2CH(CH3)2 | D. | CH3CH2CH2COOCH2CH(CH3)2 |
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(SO2)(mol•L-1) | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 | 3.00×10-37 |
| c(CO)(mol•L-1) | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 | 2.00 |
(1)在上述条件下反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)前2s内的平均反应速率v(CO2)=0.77mol/(L•s).
(3)在该温度下,反应的平衡常数K=3.33×1036.
(4)假设在密闭容器中发生上述反应,达到平衡时,下列措施既不会提高成本,又能提高SO2转化率的是BC.
A.选用更有效的催化剂 B.提高n(CO):n(SO2)投料比
C.降低反应体系的温度 D.缩小容器的体积
(5)为了分别验证不同催化剂、温度、浓度对化学反应速率的影响规律,某同学设计了四组实验使反应速率依次增大,部分实验条件已经填在下面实验设计表中.
| 实验 编号 | T(℃) | SO2初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂 |
| Ⅰ | 260 | 1.00 | 3.00 | Cr2O3 |
| Ⅱ | Fe2O3 | |||
| Ⅲ | 380 | |||
| Ⅳ | 4.00 |
②研究表明:Fe2O3的催化效果好于Cr2O3.请在答题卷相应位置画出上表中的四个实验条件下混合气体中SO2浓度随时间变化的趋势曲线图,并标明各实验编号.
| A. | 80mL 10mol•L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA | |
| B. | 2 L0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 标准状况下,11.2LSO3所含的分子数大于0.5NA |





