题目内容
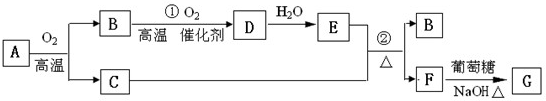
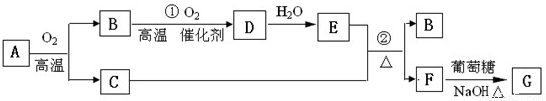
I、物质A-G有下图所示转化关系(部分反应物、生成物没有列出)其中A为某金属矿的主要成分,经过一系列反应可得到B和C.单质C可与E的浓溶液发生反应,G为砖红色沉淀.
请回答下列问题
(1)写出下列物质的化学式:B
(2)工业上B制备D在
(3)反应②的化学方程式是
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K=
II、“蓝瓶子”实验中使用的亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne- 还原型(无色)
还原型(无色)
将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被
(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被

请回答下列问题
(1)写出下列物质的化学式:B
SO2
SO2
EH2SO4
H2SO4
GCu2O
Cu2O
(2)工业上B制备D在
接触室
接触室
设备中进行.(3)反应②的化学方程式是
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2+2H2O
.
| ||
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K=
K=23.8
K=23.8
L?mol-1,若温度不变,再加入0.50mol氧气后重新达到平衡,平衡向右
向右
(填“向左”、“不变”、“向右”)移动,氧气的转化率降低
降低
,(填“升高”“不变”或“降低”),D的体积分数减小
减小
(填“增大”“不变”或“减小”)II、“蓝瓶子”实验中使用的亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色:
氧化型(蓝色)+ne-
 还原型(无色)
还原型(无色)将葡萄糖的碱性溶液放在锥形瓶中,滴加亚甲基蓝指示剂(蓝色),塞上瓶塞,溶液呈蓝色;静置一段时间,溶液褪色;振荡后,溶液又呈蓝色;再静置,又变无色;再振荡,又变蓝色…
(1)上述溶液由蓝色变无色的过程中,亚甲基蓝被
还原
还原
(填“氧化”或“还原”,下同),其中还原
还原
剂是葡萄糖
葡萄糖
(填物质名称).(2)上述溶液由无色变蓝色的过程中,亚甲基蓝被
氧化
氧化
(填“氧化”或“还原”,下同),其中氧化剂是氧气
氧气
(填物质名称).分析:Ⅰ.“G为砖红色沉淀”是本题的突破口,应为Cu2O,因此此题可以用逆向推断的方法做.不难看出,F生成G的反应是醛基的检验,所以,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2+2H2O,从平衡移动的角度计算平衡时各物质的浓度,进而计算化学平衡常数以及判断各物质的浓度的变化;
Ⅱ.亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色,根据物质的颜色,从氧化还原反应的角度判断生成物,并由此推断物质的性质和变化.
| ||
Ⅱ.亚甲基蓝(C16H18ClN3S?3H2O)是一种氧化还原型指示剂,其氧化型呈蓝色,还原型呈无色,根据物质的颜色,从氧化还原反应的角度判断生成物,并由此推断物质的性质和变化.
解答:解:Ⅰ.(1)“G为砖红色沉淀”是本题的突破口,应为Cu2O,因此此题可以用逆向推断的方法做.不难看出,F生成G的反应是醛基的检验,所以,F为CuSO4;从B→D→E,可推断为NO→NO2→HNO3或SO2→SO3 →H2SO4等.因为B→D的转化需用催化剂,可判定B为SO2,D为SO3,E为H2SO4,A应为Cu2S,
故答案为:SO2;H2SO4;Cu2O;
(2)工业上SO2制备SO3应在接触室中进行,故答案为:接触室;
(3)反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)
CuSO4+SO2+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2+2H2O;
(4)依据化学方程式:
2SO2+O2
2SO3
c(mol/L):起始 0.23 0.11 0
转化 0.12 0.06 0.12
第一次 平衡 0.11 0.05 0.12
可以求得:K=
=23.8
恒温、恒容条件下,加入0.50 mol O2后,根据勒夏特列原理,平衡右移,SO2的物质的量减少,体积分数减小,O2本身的转化率降低.设此时转化xmol/L的 O2,
2SO2+O2
2SO3
(mol/L):起始 0.11 0.05+0.50 0.12
转化 2x x 2x
第二次平衡 0.11-2x 0.55-x 0.12+2x
第一次平衡时SO3的体积分数为:
=0.429,
只要注意到可逆反应中任意物质的浓度不可能为零的特点,x的最大极限值为0.055 mol/L,所以第二次平衡时SO3的体积分数最大为:
=
=0.380,
显然,体积分数减小了.
故答案为:23.8;向右;降低;减小;
II.(1)由蓝色变无色的过程中,说明亚甲基蓝被还原,生成还原型物质,葡萄糖起到还原剂的作用,故答案为:还原;还原;葡萄糖;
(2)振荡后,溶液又呈蓝色,是由于被空气中氧气氧化,由还原型物质氧化为氧化型亚甲基蓝,故答案为:氧化;氧气.
故答案为:SO2;H2SO4;Cu2O;
(2)工业上SO2制备SO3应在接触室中进行,故答案为:接触室;
(3)反应②为浓硫酸和铜在加热条件下的反应,反应的化学方程式为Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
(4)依据化学方程式:
2SO2+O2
| ||
| △ |
c(mol/L):起始 0.23 0.11 0
转化 0.12 0.06 0.12
第一次 平衡 0.11 0.05 0.12
可以求得:K=
| 0.122 |
| 0.112×0.05 |
恒温、恒容条件下,加入0.50 mol O2后,根据勒夏特列原理,平衡右移,SO2的物质的量减少,体积分数减小,O2本身的转化率降低.设此时转化xmol/L的 O2,
2SO2+O2
| ||
| △ |
(mol/L):起始 0.11 0.05+0.50 0.12
转化 2x x 2x
第二次平衡 0.11-2x 0.55-x 0.12+2x
第一次平衡时SO3的体积分数为:
| 0.12 |
| 0.11+0.05+0.12 |
只要注意到可逆反应中任意物质的浓度不可能为零的特点,x的最大极限值为0.055 mol/L,所以第二次平衡时SO3的体积分数最大为:
| 0.12+2x |
| 0.11+0.55-x |
| 0.23 |
| 0.605 |
显然,体积分数减小了.
故答案为:23.8;向右;降低;减小;
II.(1)由蓝色变无色的过程中,说明亚甲基蓝被还原,生成还原型物质,葡萄糖起到还原剂的作用,故答案为:还原;还原;葡萄糖;
(2)振荡后,溶液又呈蓝色,是由于被空气中氧气氧化,由还原型物质氧化为氧化型亚甲基蓝,故答案为:氧化;氧气.
点评:本题考查较为综合,题目难度较大,注意根据物质的特殊颜色推断物质的可能性,用逆推的方法进行推断,把握常见元素化合物的性质.

练习册系列答案
相关题目

 还原型(无色)
还原型(无色)