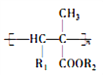
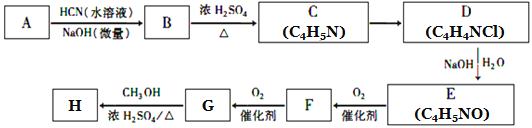
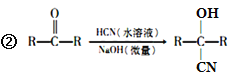
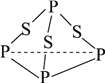
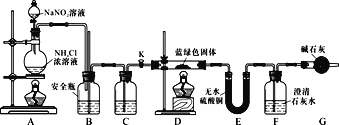
��Ŀ����
����Ŀ����������7�����ʣ���NaOH����NaHCO3����HCl����CH3COOH����C2H5OH����Al����ʳ��ˮ��
��1����������������ǿ����ʵ���________(�����)������������ʵ���________(�����)�����ڷǵ���ʵ���________(�����)�����ܸ����ᷴӦ���ܸ�NaOH��Һ��Ӧ����____________(�����)��
��2����������ˮ��Һ�ʼ��Ե�ԭ����(�����ӷ���ʽ��ʾ) ______________________��
��3����������ˮ��Һ�����Ե�ԭ����(�����ӷ���ʽ��ʾ)__________________��
���𰸡� �٢ڢ� �� �� �ڢ� HCO3-+H2O![]() H2CO3+OH- CH3COOH
H2CO3+OH- CH3COOH![]() CH3COO-+H+
CH3COO-+H+
����������NaOH��ǿ�����ǿ���������NaHCO3�����Σ���ǿ����ʣ����������ᷴӦ���ɶ�����̼���壬�������������Ʒ�Ӧ����̼���ƣ���HCl����ǿ�ᣬ��ǿ����ʣ�ֻ�ܺ��������Ʒ�Ӧ����CH3COOH�����ᣬ���������������C2H5OH���ڷǵ���ʣ���Al���ܸ�NaOH��Һ��Ӧ�����ܸ����ᷴӦ���Ȳ��ǵ����Ҳ���Ƿǵ���ʣ���ʳ��ˮ���ڻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʡ�
(1)������������������ǿ����ʵ��Ǣ٢ڢۣ�����������ʵ��Ǣ������ڷǵ���ʵ��Ǣ����ܸ����ᷴӦ���ܸ�NaOH��Һ��Ӧ���Ǣڢޣ��ʴ�Ϊ���٢ڢ������������ڢ���
(2)NaHCO3��̼��������ӻ�ˮ�⣬������Һ��ʾ���ԣ�ʵ���ǣ�HCO3-+H2O![]() H2CO3+OH-���ʴ�Ϊ��HCO3-+H2O
H2CO3+OH-���ʴ�Ϊ��HCO3-+H2O![]() H2CO3+OH-��
H2CO3+OH-��
(3)CH3COOH�����ᣬ����CH3COOH![]() CH3COO-+H+����ƽ�⣬��Һ�����ԣ��ʴ�Ϊ��CH3COOH
CH3COO-+H+����ƽ�⣬��Һ�����ԣ��ʴ�Ϊ��CH3COOH![]() CH3COO-+H+��
CH3COO-+H+��

����Ŀ���±���ǰ20��Ԫ���еIJ���Ԫ�ص�һЩ���ݣ�
A | B | C | D | E | F | G | H | I | J | |
ԭ�Ӱ뾶(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
���̬ | +6 | +1 | �� | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
��ͼ�̬ | -2 | �� | -2 | �� | -4 | -3 | -1 | �� | -3 | -4 |
�Իش��������⣺
(1)����10��Ԫ�ص縺��������_____(��Ԫ�ط���)����Ԫ��Bԭ��������7��Ԫ����Ԫ�����ڱ��е�λ�ã���_____���ڣ���_____�壬���̬ԭ�ӵĺ�������Ų�ʽ��________��
(2)H��I��J����Ԫ�ض�Ӧ���ʵ��۵��������ߵ�˳����(�õ��ʵľ��廯ѧʽ����)__________��
(3)Ԫ��E��C����Ԫ�ؿ��γ�һ����Է�������Ϊ60��һԪ������ӡ�������й��γ�________���Ҽ���________���м���
(4)I����Ԫ���γɵ�10���ӷ���X�Ŀռ乹��Ϊ________����X����ˮ�����Һ���뵽CuSO4��Һ�����������õ��������ӵĻ�ѧʽΪ________������X��Cu2+֮����_____________����ϡ�
(5)��ͼ��IԪ���γɵĺ�����Ľṹ�����Ҫ˵��������������ˮ��ԭ��
a._________________________________��
b._________________________________��
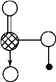
(6) ��ͼ��J��E��ɵľ���ṹ����ÿ����J��Χ���Jԭ����ĿΪ_________���������߳�Ϊa cm��������ܶ�Ϊ_______________���ú�a��NA�Ĵ���ʽ��ʾ��(g/mL)��