题目内容
【题目】对下列事实的解释正确的是( )
A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B.分别用盛满HCl气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同
C.向50 mL 18 molL﹣1 的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
【答案】B
【解析】解:A.氯气可以使湿润的有色布条褪色,但氯气不能是干燥的有色布条褪色,说明氯气不具有漂白性,故A错误; B.设烧瓶容积均为V,该稳定性气体摩尔体积为Vm,HCl极易溶于水,水可充满烧瓶,NO2气体与水发生3NO2+H2O=2HNO3+NO,水不能充满,盛有HCl的烧瓶中所得溶液浓度为: ![]() =
= ![]() mol/LL,盛有HCl的烧瓶中所得溶液浓度为:
mol/LL,盛有HCl的烧瓶中所得溶液浓度为: ![]()
![]() mol/L,所得溶液的物质的量浓度相同,故B正确;
mol/L,所得溶液的物质的量浓度相同,故B正确;
C.50 mL 18 0.9molL﹣1 的H2SO4溶液中含有硫酸的物质的量为0.9mol,由于浓硫酸变成稀硫酸后反应停止,则被还原的H2SO4的物质的量小于0.45 mol,故C错误;
D.常温下浓硝酸可以用铝制容器贮存,原因是铝与浓硝酸发生了钝化现象,不是不反应,故D错误;
故选B.

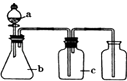
【题目】下表中a、b、c表示相应仪器中加人的试剂,可用如图装置制取、净化、收集的气体是( )
编号 | 气体 | a | b | c |
|
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 | |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | |
C | NO | 稀硝酸 | 铜屑 | H2O | |
D | Cl2 | 浓盐酸 | 二氧化锰 | 饱和NaCl溶液 |
A.A
B.B
C.C
D.D
【题目】在温度、容积相同的三个密闭容器中发生反应N2(g) + 3H2(g)![]() 2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
2NH3(g) ΔH= -92.4kJ/mol,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
NH3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强 | P1 | P2 | P3 |
反应物转化率 | α1 | α2 | α3 |
下列说法正确的是
A. 2 c1>c3 B. a + b=92.4 C. 2P1<P3 D. α1 +α3=1