题目内容
15.我们日常所见到的颜色鲜艳的花果,如红、黄、蓝、绿色水果,都含有类黄酮,类黄酮为这类花果提供了植物色素.科学研究发现,类黄酮这一化学物质,在人体内经细菌分解就会转化为二羟基苯甲酸,它有抑制甲状腺功能的作用.二羟基苯甲酸的结构简式为: ,对于二羟基苯甲酸的下列说法,不正确的是( )
,对于二羟基苯甲酸的下列说法,不正确的是( )| A. | 二羟基苯甲酸既具有羧酸的性质,又具有酚的性质 | |
| B. | 1mol二羟基苯甲酸只能与1mol NaOH发生中和反应 | |
| C. | 二羟基苯甲酸溶液中滴加三氯化铁溶液,可以得到紫色溶液 | |
| D. | 二羟基苯甲酸可通过甲苯的氧化、取代、水解等反应制得 |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有羧基,具有酸性,可发生中和、酯化反应,以此解答该题.
解答 解:A.含有羧基和酚羟基,具有羧酸和酚的性质,故A正确;
B.含有2个酚羟基和羧基,1mol二羟基苯甲酸可能与3mol NaOH发生中和反应,故B错误;
C.含有酚羟基,可与氯化铁发生显色反应,故C正确;
D.甲苯氧化可生成苯甲酸,与溴发生取代、水解可生成酚羟基,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质,为解答该类题目的关键,难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
5.有效碰撞是指( )
| A. | 反应物分子间的碰撞 | B. | 反应物活化分子间的碰撞 | ||
| C. | 反应物分子发生合适取向的碰撞 | D. | 活化分子之间发生合适取向的碰撞 |
3.下列叙述正确的是( )
| A. | 从HF、HCl、HBr、HI的酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律 | |
| B. | N的非金属性比P强,N2的活动性比磷单质的强 | |
| C. | Li、Na、K的原子半径和单质密度随原子序数的增加而增大 | |
| D. | 从氢硫酸露空放置容易变质,产生浑浊的事实,推出O的非金属性比S强 |
10.已知污染性气体氮氧化物能用碱液除去,反应如下:
2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液完全吸收的是( )
2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液完全吸收的是( )
| A. | 1mol O2和4mol NO2 | B. | 1mol O2和4mol NO | ||
| C. | 1mol NO和5mol NO2 | D. | 4mol NO和1mol NO2 |
9.环己酮是一种重要的有机化工原料,主要用于制造己内酰胺和己二酸.
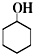 +Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$
+Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$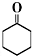 +H2O
+H2O
实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
实验步骤如下:

①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是环己醇氧化为环己酮为放热反应,防止温度过高副反应增多.
(2)步骤③利用图示装置进行实验的目的是蒸馏出产品环已酮,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是系统有堵塞现象,此时应立即采取的措施是打开止水夹K(让水蒸汽发生器和大气相通).
(3)步骤④中操作的正确顺序是d b e c a,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗,在上述操作d中加入NaCl 固体的作用是增加水层的密度,有利于分层,e中加入无水MgSO4的作用是干燥剂,蒸馏除乙醚的过程中采用的加热方式为水浴加热.
(4)写出该实验中可能发生的一个副反应的化学方程式 .
.
 +Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$
+Na2Cr2O7+H2SO4$\stackrel{55℃~60℃}{→}$ +H2O
+H2O实验室可用环己醇氧化制取环己酮(已知该反应为放热反应):环己醇、环己酮和水的部分物理性质见下表:
| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水和醚 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水,能溶于醚 |
| 水 | 100.0 | 0.9982 |
实验步骤如下:

①将重铬酸钠溶于适量水,边搅拌边慢慢加入浓H2SO4,将所得溶液冷至室温备用.
②在一圆底烧瓶(乙)中加入适量环己醇,并将①中溶液分三次加入圆底烧瓶,每加一次都应振摇混匀.
控制瓶内温度在55℃~60℃之间,充分反应0.5h.
③向②反应后的圆底烧瓶内加入少量水,并接入图所示装置中,将T形管的活塞K打开,甲瓶中有适量水,加热甲,至有大量水蒸气冲出时,关闭K,同时接通冷凝水.
④将步骤③锥形瓶中收集到的液体经过以下一系列操作可得纯净的环己酮:a、蒸馏,除去乙醚后,收集151℃~155℃馏分;b、水层用乙醚(乙醚沸点34.6℃,易燃烧,当空气中含量为1.83~48.0%时易发生爆炸)萃取,萃取液并入有机层;c、过滤;d、往液体中加入NaCl 固体至饱和,静置,分液; e、加入无水MgSO4固体.根据以上步骤回答下列问题:
(1)步骤①所得溶液分三次加入环己醇的原因是环己醇氧化为环己酮为放热反应,防止温度过高副反应增多.
(2)步骤③利用图示装置进行实验的目的是蒸馏出产品环已酮,实验过程中要经常检查甲中玻管内的水位.若玻管内的水位升高过多,其可能原因是系统有堵塞现象,此时应立即采取的措施是打开止水夹K(让水蒸汽发生器和大气相通).
(3)步骤④中操作的正确顺序是d b e c a,上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需漏斗、分液漏斗,在上述操作d中加入NaCl 固体的作用是增加水层的密度,有利于分层,e中加入无水MgSO4的作用是干燥剂,蒸馏除乙醚的过程中采用的加热方式为水浴加热.
(4)写出该实验中可能发生的一个副反应的化学方程式
 .
.