题目内容
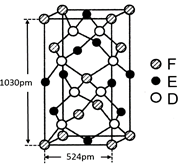
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

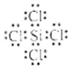
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
(1)b
(2)氩 Na+(钠离子)
(3)MgO的熔点高,熔融时耗费更多资源,增加生产成本
AlCl3是共价化合物,熔融态难导电
(4)
SiCl4(g)+2H2(g) Si(s)+4HCl(g) ?H=" +0.025" kJ?mol?1
Si(s)+4HCl(g) ?H=" +0.025" kJ?mol?1
(5)b
(6)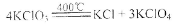
解析试题分析:(1)a、原子序数递增,离子半径也可能增大,错误;b、第三周期随原子序数的递增,金属性减弱,非金属性增强,增强;c、没有指明为最高价氧化物,错误;d、单质的熔点也可能增大,错误。
(2)第三周期原子最外层电子数与次外层电子数相同的元素是氩,都是8;氧化性最弱的是简单阳离子是Na的阳离子,Na+
(3)MgO的熔点远远大于MgCl2的熔点,熔融时耗费更多资源,增加生产成本;AlCl3是共价化合物,熔融态难导电,所以不能电解熔融AlCl3。
(4)SiCl4中Si分别与Cl形成1对共用电子,所以电子式为: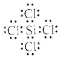
生成1.12kg纯硅需吸收akJ热量,则生成28g纯硅需吸收0.025 kJ,可得热化学方程式。
(5)NH3既不能用浓硫酸干燥,也不能用P2O5干燥,HI不能用浓硫酸干燥,可用P2O5干燥,SO2不能用浓硫酸干燥,CO2能用浓硫酸干燥,所以b项正确。
(6)一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,根据氧化还原反应原理,这两种盐为KCl、KClO4,配平可得化学方程式。
考点:本题考查元素周期律、元素的推断、电子式和热化学方程式的书写、干燥剂、氧化还原反应原理。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案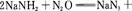
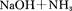
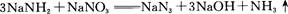 回答下列问题:
回答下列问题: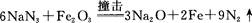
 ③白磷 ④18O ⑤
③白磷 ④18O ⑤
 、
、