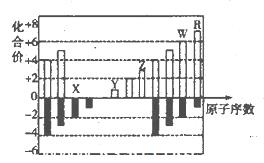
题目内容
[物质结构与性质]
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。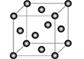
(1)[Ar]3d10
(2) HF
(3) sp2 6mol
(4) CH3CHO+NaOH+2Cu(OH)2 △H3COONa+Cu2O↓+3H2O
△H3COONa+Cu2O↓+3H2O
(5) 12
解析试题分析:(2)等电子体为原子数相同,价电子数相同;(3)醛基中碳原子有碳氧双键,为sp2杂化;根据结构得出共含有6molσ键;(5)铜晶体中每个铜原子周围距离最近的铜原子为一个平面上对角线上的原子,每个平面4个,有3各面共12个。
考点:本题考查物质结构有关内容。

 备战中考寒假系列答案
备战中考寒假系列答案(10分)下表为元素周期表中的一部分.用化学式或元素符号回答下列问题:
| | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | | | | ⑥ | | ⑦ | | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | ⑨ | |
(2)在①②⑤的最高价氧化物的水化物中,碱性最强的是__________(填化学式)。
(3)元素⑦的常见的氢化物的化学式为__ __,该氢化物常温下和元素②的单质反应的离子方程式是:_______________________,该氢化物与元素⑧的单质反应的离子方程式是___________________________。
(4)①和⑨的最高价氧化物对应的水化物化学式分别为___________和_______。
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为__________________
(6)⑧与⑨分别与H2形成的氢化物的稳定性:__________,(用化学式表示)最高价氧化物对应的水溶液的酸性:_______________。(用化学式)
(14分)元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a.原子序数和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水合物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a. NH3 b. HI c. SO2 d . CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
| 元素 | A | B | C | D | E |
| 相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。

(24分)下表是元素周期表的一部分,针对表中①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | ④ | |
| 3 | ⑤ | ⑥ | ⑦ | | | | ⑧ | |
| 4 | ⑨ | ⑩ | | | | | | |
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 。
(3)最高价氧化物是两性氧化物的元素在第 族;写出它的氧化物与氢氧化钠溶液反应的离子方程式 。
(4)从⑤到⑧的元素中, 原子半径最大(填元素符号)。
(5)元素④与⑥形成的化合物属于 (填 “共价”或“离子”)化合物。
(6)若要比较⑤比⑥的金属性强弱,下列实验方法可行的是 。
A、将单质⑤置于⑥的盐溶液中,如果⑤不能置换出单质⑥,说明⑤的金属性弱
B、比较⑤和⑥的最高价氧化物对应水化物的水溶性,前者比后者溶解度大,故前者金属性强
C、将⑤、⑥的单质分别投入到水中,观察到⑤与水反应更剧烈,说明⑤的金属性强
D、将⑤、⑥的单质分别在O2中燃烧,前者得到氧化物的颜色比后者得到氧化物的颜色深,则前者金属性强