题目内容
【题目】某物质在灼烧时透过蓝色钻玻璃看到火焰呈紫色,说明该物质中一定含有( )
A.钾原子
B.钾离子
C.钾元素
D.钾的化合物
【答案】C
【解析】用洁净的铂丝蘸取某无色溶液,放在无色火焰上灼烧,透过蓝色钴玻璃,火焰的颜色呈紫色说明溶液中有钾元素,如果不透过蓝色钴玻璃,能直接看到黄色火焰,说明含有钠元素.故该溶液中可能含有钠元素,但一定含有钾元素.C符合题意;
故答案为:C.
钾的焰色反应,要透过蓝色钴玻璃滤去黄色光呈现紫色。

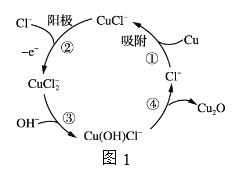
【题目】氨基甲酸铵(H2NCOONH4)是一种易分解、易水解的白色固体,某研究小组以氢氧化钠固体、浓氨水、干冰等为原料制备氨基甲酸铵的实验装置如图所示,其主要反应的原理为2NH3(g)+CO2(g)![]() NH2COONH4(s) △H<O。
NH2COONH4(s) △H<O。
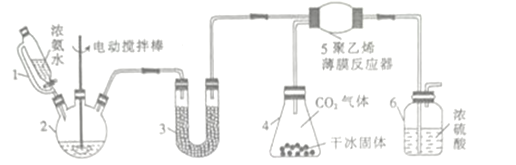
(1)仪器2的名称是________,仪器3中盛装的固体是_________,其作用是______________。
(2)仪器6的一个作用是控制原料气按反应计量系数充分反应,若反应初期观察到装置内浓硫酸中产生气泡,则应该______________(填“加快”“ 减慢”或“不改变”)产生氨气的速率。
(3)另一种制备氨基甲酸氨的反应装置(液体石蜡和CCl4均充当惰性介质)如图所示。
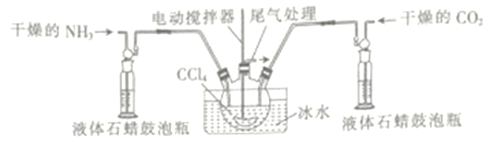
①液体石蜡鼓泡瓶的作用是_____________________ 。
②若无冰水,则氨基甲酸铁易分解生成尿素[CO(NH)2]2请写出氨基甲酸铵受热分解的化学方程式:_______________________。
③当CCl4液体中产生较多晶体悬浮物时,立即停止反应,过滤分离得到粗产品,为了将所得粗产品干燥,可采取的方法是_______________(填字母)。
A.蒸馏 B.真空微热烘干 C.高压加热烘干
(4)制得的氨基甲酸铵中可能含有碳酸氢铵、碳酸铵中的一种或两种杂质(不考虑氨基甲酸铵与水的反应)。
①设计方案进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
实验步骤 | 预期现象和结论 |
步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解 | 得到无色溶液 |
步骤2:向试管中加入过量的BaCl2溶液,静置 | 若溶液不变浑浊,则证明固体中不含碳酸铵 |
步骤3:向试管中继续加入___________ | _____________________________, 则证明固体中含有碳酸氢铵 |
②根据①的结论,取15.8g氨基甲酸氨样品,用足量氢氧化钡溶液充分处理后,过滤洗涤、干燥测得沉淀质量为1.97g。则样品中氨基甲酸铵的质量分数为_________________。
【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是
组合 | 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 |
A | 氨水 | 食盐水 | 硫酸 | 醋酸 | 干冰 |
B | 氧化铁 | 家用食醋 | 硫酸钡 | 碳酸 | 蔗糖 |
C | 胆矾 | 碘酒 | 苛性钠 | 碳酸 | 碳酸钙 |
D | 盐酸 | 氯化钾溶液 | 氯化钠 | 氢氧化铜 | 氢气 |
A.AB.BC.CD.D