题目内容
(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
(1) 将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀。
① 把反应物研细的目的是____________________。
② 检验沉淀是否洗涤干净,应选用试剂是________。
(2) 向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾。
① 大量的白雾的成分是________(填化学式)。
② 适度加热但温度不能过高的原因是____。
(3) 25 ℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为________。(已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39)
(4) 某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体。请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):① 将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;② ________,过滤;③ 将滤液________,得到CuCl2·2H2O晶体;④ 将________,得到无水氯化铜固体。
(1) ① 增大反应物之间的接触面积,使反应速率增大(其他合理答案均可)(2分)
② HNO3和AgNO3溶液(其合理答案均可)(2分)
(2) ① HClO4(1分) ② 防止HClO4、Cu(ClO4)2分解(2分)
(3) 2.64×10-6 mol·L-1(2分)
(4) ② 加入适量双氧水溶液并充分混合,再加入适量氨水调节溶液pH至3.2~4.7(2分)
③ 加热浓缩,冷却结晶,过滤、(冰水)洗涤,干燥(2分)
④ CuCl2·2H2O晶体在HCl气氛中加热至质量不再变化为止(2分)
解析试题分析:(1)增大反应物之间的接触面积,使反应速率增大;反应生成沉淀和氯化钠,洗涤目的除去沉淀表面的氯化钠等杂质,所以检验洗涤液中是否含有氯离子即可,用HNO3和AgNO3溶液检验;(2)HClO4是易挥发的发烟液体,反应中挥发出形成白雾;产物和反应物HClO4、Cu(ClO4)2均不稳定,反应温度不宜过高防止它们分解;(3)Ksp=c(Fe3+) c3(OH-)=2.64×10-39,c(Fe3+)=2.64×10-6 mol·L-1;(4)该操作时物质的提纯,主要步骤是除去杂质,然后结晶,具体操作为先把亚铁离子氧化为铁离子,然后调节pH形成沉淀除去,再结晶得到CuCl2·2H2O晶体,由于CuCl2水解加热最终得到氧化铜,故需在氯化氢的氛围中加热除去结晶水。
但该题信息中没有给出氯化氢试剂。
考点:考查实验综合有关问题。

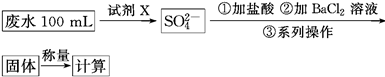
下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象与结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol·L-1 H2SO4溶液 | 试管口出现红棕色气体。则溶液中NO3-被Fe2+还原为NO2 |
| B | 向样品溶液中先滴加过量的稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀。说明样品溶液中一定含有SO42- |
| C | 向0.1mol·L-1 Na2CO3溶液中,滴加2滴酚酞显浅红色,微热 | 红色加深。说明盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成。表明淀粉没有水解生成葡萄糖 |
(12分)为回收和利用废旧塑料减轻“白色污染”,某兴趣小组进行如下探究:
| 实验课题 | 探究废旧塑料热分解的主要产物为多种烃的混合物 |
| 查阅资料 | ①CuO能将烃氧化成CO2和H2O; ②甲苯可被酸性KMnO4溶液氧化为苯甲酸,苯甲酸能溶于苯。 |
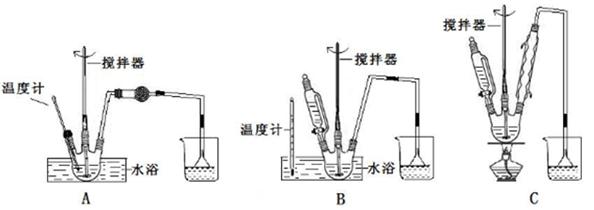
| 实验设计 |   |
| 实验记录 | 按上图连接装置,隔绝空气强热装置A中的试管(忽略装置内空气的影响),一段时间后,可观察到如下现象: ①B装置试管中有液态物质生成; ②C中溴水的颜色变浅; ③E中黑色氧化铜变红; ④F中无水硫酸铜变蓝。 |
(1)写出一定条件下制备聚丙烯化学方程式 。
(2)经分析得知装置B试管中的液态产物是甲苯和苯的混合物。设计实验除去其中含有的甲苯 。
(3)实验中装置C的作用是 。
(4)若没有装置D,对实验结论产生的影响是 。
(5)有同学认为“E中黑色氧化铜变红,F中无水硫酸铜变蓝”是废旧聚丙烯塑料热分解产物中含氢气导致的。请你在F装置后增加一个实验装置,以确认使CuO变红是气态烃,而不是氢气,将增加的装置图(要注明其中盛放的试剂名称)画在虚线框内。

葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |

请回答下列问题:
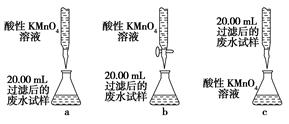
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是________。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ. 探究银镜反应的最佳实验条件部分实验数据如下表:
| 实验变量 实验序号 | 银氨溶液 /mL | 乙醛的量 /滴 | 水液温度/℃ | 反应混合液的PH | 出现银镜时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
| 4 | 1 | 3 | 30 | 11 | 9 |
| 5 | 1 | 3 | 50 | 11 | 6 |
| 6 | 1 | 5 | 80 | 11 | 3 |
请回答下列问题:
(1)读表若只进行实验1和实验3,其探究目的是 。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
(3)进一步实验 若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
。
Ⅱ. 探究对废液的回收处理:
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为:
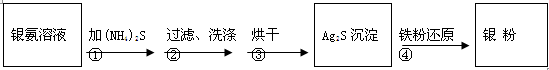
操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl
 2 Ag+ FeCl2+H2S↑。
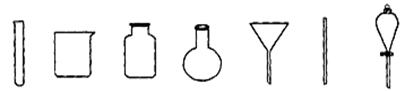
2 Ag+ FeCl2+H2S↑。(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为: ,需要用到的玻璃仪器有 (填编号)。
a b c d e f g
(5)操作④应在(填实验室设备名称) 中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。