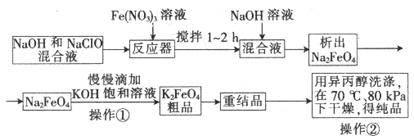
题目内容
某废水样品中含有一定量的K+、HCO3—、SO32—,甲、乙两研究小组欲测定其中SO32—的浓度。
甲组方案: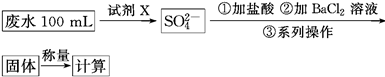
乙组方案:
①用烧杯盛取废水适量,加适量活性炭除色;过滤,取滤液。
②精确量取20.00 mL过滤后的废水试样,用0.1 mol·L-1紫色KMnO4(H2SO4酸化)溶液进行滴定(有关反应为2MnO4—+5SO32—+6H+=2Mn2++5SO42—+3H2O)。
③记录数据,计算。
(1)甲组方案中的“试剂X”可选用________。
a.0.1 mol·L-1 KMnO4(H2SO4酸化)溶液
b.0.5 mol·L-1 KOH溶液
c.新制氯水
d.NaI溶液
(2)甲组方案中,加入试剂X后生成SO42—的离子方程式为________________。
(3)甲组方案中,第③步的“系列操作”包含的操作名称依次为__________________。
(4)为乙组方案设计的下列滴定方式中,最合理的是________(填字母序号),达到滴定终点时可观察到的现象是__________________。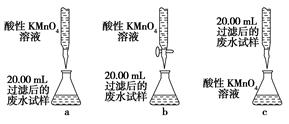
(1)c
(2)SO32—+Cl2+H2O=SO42—+2Cl-+2H+
(3)过滤、洗涤、干燥
(4)b 溶液由无色变为紫红色
解析

(15分)高氯酸铜[Cu(ClO4)2·6H2O]易溶于水,120 ℃开始分解,常用于生产电极和作催化剂等。可由氯化铜通过下列反应制备:2CuCl2+2Na2CO3+H2O===Cu2(OH)2CO3↓+CO2↑+4NaCl;Cu2(OH)2CO3+4HClO4+9H2O===2Cu(ClO4)2·6H2O+CO2↑。HClO4是易挥发的发烟液体,温度高于130 ℃易爆炸。下表列出相应金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1 mol·L-1):
| 金属离子 | 开始沉淀 | 沉淀完全 |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Cu2+ | 4.7 | 6.7 |
(1) 将CuCl2和Na2CO3用研钵分别研细,加入适量的沸水,搅拌,加热成蓝棕色溶液。静置、冷却、过滤、洗涤得蓝色Cu2(OH)2CO3沉淀。
① 把反应物研细的目的是____________________。
② 检验沉淀是否洗涤干净,应选用试剂是________。
(2) 向Cu2(OH)2CO3沉淀中滴加稍过量的HClO4小心搅拌,适度加热后得到蓝色Cu(ClO4)2溶液同时会产生大量的白雾。
① 大量的白雾的成分是________(填化学式)。
② 适度加热但温度不能过高的原因是____。
(3) 25 ℃时,若调节溶液pH=3,则溶液中的Fe3+的物质的量浓度为________。(已知25 ℃时,Fe(OH)3的Ksp=2.64×10-39)
(4) 某研究小组欲用粗CuCl2固体(含Fe2+)制备纯净的无水氯化铜固体。请补充完整由粗CuCl2固体制备纯净的无水氯化铜固体的实验步骤(可选用的试剂:蒸馏水、稀盐酸、双氧水溶液和氨水):① 将粗CuCl2固体溶于蒸馏水,滴入少量的稀盐酸;② ________,过滤;③ 将滤液________,得到CuCl2·2H2O晶体;④ 将________,得到无水氯化铜固体。
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用铁屑为原料制备,相关反应过程如下,请回下列问题: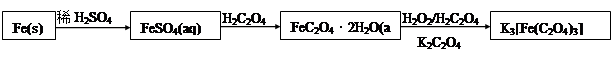
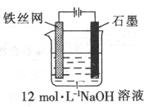
(1)铁屑中常含硫元素,因而在制备FeSO4时会产生有毒的H2S气体,该气体可用氢氧化钠溶液吸收。下列吸收装置正确的是 。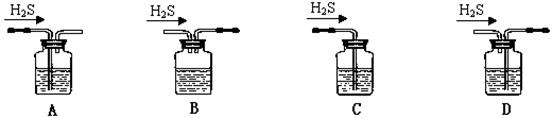
(2)在得到的FeSO4溶液中需加入少量的H2SO4酸化,目的是 ,得到K3[Fe(C2O4)3]溶液后,加入乙醇的目的是 。
(3)晶体中所含结晶水可通过重量分析法测定,主要步骤有:①称量,②置于烘箱中脱结晶水,③冷却,④称量,⑤重复②~④至恒重,⑥计算。
步骤③需要在干燥器中进行的原因是 ;
步骤⑤的目的是 。
(4)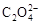 可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
可被酸性KMnO4溶液氧化放出CO2气体,所以实验产物中K3[Fe(C2O4)3]·3H2O含量测定可用KMnO4标准溶液滴定。
①写出滴定过程中发生反应的离子方程式 ;
②下列滴定操作中使滴定结果偏高的是 ;
| A.滴定管用蒸馏水洗涤后,立即装入标准液 |
| B.锥形瓶在装待测液前未用待测液润洗 |
| C.滴定前滴定管尖嘴处有气泡,滴定后气泡消失 |
| D.读取标准液体积时,滴定前仰视读数,滴定后俯视读数 |
工业上用铁屑还原法制备碘化钠的主要流程如下图: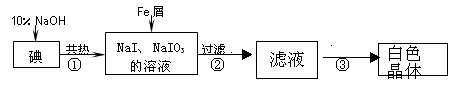
(1)碘元素位于周期表中第 周期,第 族;
(2)反应①的化学方程式 ;
(3)判断反应①中碘是否已完全反应的操作是 ;
(4)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,采取的措施最好是 ;
(5)某同推测步骤③中得到的白色晶体是NaI、NaIO3和NaOH的混合物,设计如下方案进行检验,实验结果表明其推测正确。
已知:IO3-十5I-+6H+=3I2+3H2O;NaIO3水溶液呈中性。
限选试剂:lmol/LH2SO4,2mol/LHNO3、淀粉溶液、酚酞试液、石蕊试液、蒸馏水。其它仪器和用品自选。
| 实验方案 | 实验现象 | 结论 |
| 将白色晶体溶于水,并滴2滴淀粉溶液 | 得到无色溶液 |  |
| 取少量溶液液于试管A中, . | 溶液显蓝色 | 溶液中含IO3一 |
| 另取少量溶液液于试管B中, . | . | 溶液中含大量0H一 |
要得到更纯的NaI,还需进一步的操作是 (填操作名称)
三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__ 。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由 .
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式 。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg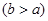 ,则混合物中Cu2O的质量分数为 。
,则混合物中Cu2O的质量分数为 。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
| 物 质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择: A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
实验小组设计如下实验方案:
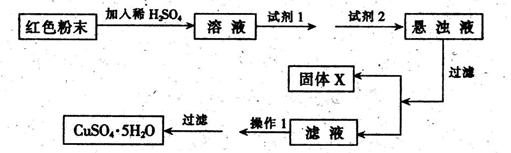
试回答:①试剂1为___ _,试剂2为 (填字母)。
②固体X的化学式为____,③操作I为_ 。