题目内容
【题目】(一)电解法制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。某校实验小组精制粗盐水的实验过程如下:
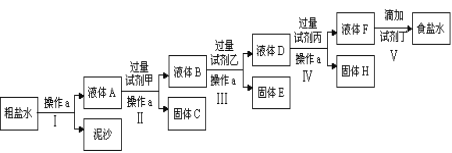
请回答以下问题:
(1)操作a的名称是______________,所用玻璃仪器有_________________;
(2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量的难溶沉淀,则试剂甲为(填化学式)_______________溶液;
(3)写出固体H所含物质的化学式_________________________________;
(4)在Ⅴ步中,逐滴加入试剂丁直至溶液无明显变化时,写出此过程中发生反应的离子方程式____________________________________________。
(二)某次实验需用0.4 mol·L-1 NaOH溶液500 mL。若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏低的是__________,对实验结果没有影响的是________(填字母代号)。
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线
【答案】过滤 玻璃棒、普通漏斗、烧杯 NaOH CaCO3 BaCO3 H++OH-=H2O 2H++CO32-=CO2↑+H2O BEG C
【解析】
(一)流程是操作Ⅰ通过过滤除去不溶性杂质,得到溶液A中含有杂质离子Ca2+、Mg2+、Fe3+、SO42-杂质,加入过量试剂甲为氢氧化钠沉淀铁离子和镁离子,过滤得到溶液B中含有Ca2+、OH-、SO42-杂质,加入过量试剂乙为氯化钡沉淀硫酸根离子,过滤得到溶液D中含有OH-、Ca2+、Ba2+,加入过量碳酸钠溶液,除去Ca2+、Ba2+,过滤得到溶液F中含有氢氧根离子、碳酸根离子,加入适量盐酸到不再有气体产生得到较纯净的食盐水;
(二)分析操作对溶质的物质的量及溶液体积的影响,依据c=n/V进行误差分析,凡是使n偏小或者V偏大操作,都会导致溶液浓度偏低,反之导致溶液浓度偏高,据此分析解答。
(一)(1)在食盐水中,实现溶液和泥沙难溶物的分离可以采用过滤的方法,即操作a的名称是过滤,所用玻璃仪器有玻璃棒、普通漏斗、烧杯;
(2)粗盐中含有Ca2+、Mg2+、Fe3+、SO42-杂质,加入过量试剂氢氧化钠后,可以将镁离子以及铁离子形成氢氧化镁和氢氧化铁沉淀,即试剂甲为NaOH;
(3)氯化钡可以让硫酸根离子形成硫酸钡沉淀,碳酸钠可以让钙离子以及过量的钡离子形成碳酸钙和碳酸钡沉淀,并且碳酸钠必须加在氯化钡之后,因此固体H所含物质的化学式为CaCO3、BaCO3;
(4)在第Ⅴ步中,加入试剂盐酸可以把过量的氢氧化钠以及过量的碳酸钠除掉,此过程的离子反应方程式为H++OH-=H2O、2H++CO32-=CO2↑+H2O;
(二)A.所用的NaOH中混有少量Na2O,相同量的氧化钠生成氢氧化钠的物质的量多,所以导致溶质的物质的量偏大,溶液浓度偏高;
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥,导致称取固体中含有氢氧化钠质量偏小,溶质的物质的量偏小,溶液浓度偏低;
C.配制溶液所用的容量瓶洗净后没有烘干,对溶质的物质的量和溶液体积都不产生影响,溶液浓度无影响;
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作,冷却后溶液体积偏小,溶液浓度偏高;
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低;
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线,导致溶液体积偏小,溶液浓度偏高;
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低;
所以使所配制的NaOH溶液的浓度偏低的是BEG;对实验结果没有影响的是C。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案