��Ŀ����
����Ŀ��ԭ�������������������Ԫ��A��B��C��D��Eλ�����ڱ���ǰ�����ڣ�A��̬ԭ�ӵ�2p�������2��δ�ɶԵ��ӣ�C�������������Ǵ�����������3����C��Dͬ�������ڣ�Eλ�����ڱ���ds���������ֻ��һ�ԳɶԵ��ӡ���ش��������⣺
��1��д����Ԫ�ط��ţ�A________��B________��C________��D________��E________��
��2��DԪ����Ԫ�����ڱ��е�λ����_______________����̬Eԭ�ӵĵ���ռ��_____��������ͬ��ԭ�ӹ����
��3��AԪ�ؿ��γɶ��ֵ��ʣ����з��Ӿ���ķ���ʽΪ________��ԭ�Ӿ����������_______����ÿ����������ͼ�ף�ʵ�ʺ���______��Aԭ�ӣ�A��һ�ֵ���Ϊ��״�ṹ�ľ��壬�����д��ڵ���������____________��������ÿ����С������_____��ԭ�ӡ�
��4����д��B�ĵ��ʵĵ���ʽ___________��������AC2�Ľṹʽ___________��
����KMnO4������Һ����DC2����ʱ��MnO4������ԭΪMn2+���÷�Ӧ�����ӷ���ʽΪ________________________________________________��
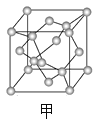
��5��D��E���γɻ�����X��X��һ�־��徧���ṹ��ͼ����ʾ��X�Ļ�ѧʽΪ______��D���ӵ���λ��Ϊ______���������߳�Ϊa cm������X���ܶȼ���ʽΪ��=______________gcm-3����a��NA�Ĵ���ʽ��ʾ����

���𰸡� C N O S Zn �������ڢ�A�� 7 C60 ���ʯ 8 ���ۼ������»��� 2 ![]() O=C=O 5SO2+2MnO4-+2H2O�T2Mn2++5SO42-+4H+ ZnS 4 388/(NAa3)
O=C=O 5SO2+2MnO4-+2H2O�T2Mn2++5SO42-+4H+ ZnS 4 388/(NAa3)
��������ԭ�������������������Ԫ��A��B��C��D��Eλ�����ڱ���ǰ�����ڣ�C�������������Ǵ�����������3������C���������6�����ӣ�CΪOԪ�أ�C��Dͬ�������ڣ���DΪSԪ�أ�A��̬ԭ�ӵ�2p�������2��δ�ɶԵ��ӣ�����A��ԭ��������OС������AΪCԪ�أ�B��ԭ����������A. C֮�䣬����BΪNԪ�أ�Eλ�����ڱ���ds���������ֻ��һ�ԳɶԵ��ӣ���EΪZnԪ�ء�
(1). �����Ϸ�����֪��AΪCԪ�ء�BΪNԪ�ء�CΪOԪ�ء�DΪSԪ�ء�EΪZnԪ�أ��ʴ�Ϊ��C��N��O��S��Zn��
(2). DΪSԪ�أ����������Ӳ㣬�������6�����ӣ�����SԪ��λ��Ԫ�����ڱ��ĵ������ڵ�VIA�壬��̬Znԭ�ӵĺ�������Ų�ʽΪ��[Ar]3d104s2��ռ��7��������ͬ��ԭ�ӹ�����ʴ�Ϊ����������VIA�壻7��
(3). A��CԪ�أ������γɽ��ʯ��ʯī��C60�ȶ��ֵ��ʣ�����C60Ϊ���Ӿ��壬����ԭ�Ӿ�����ǽ��ʯ���ɽ��ʯ�ľ����ṹʾ��ͼ��֪��Cԭ�ӷֱ�λ�ڶ��㡢������ڣ����ݡ���̯�����У�8��1/8+6��1/2+4=8����ÿ��������ʵ�ʺ���8��Cԭ�ӣ�̼��һ�ֵ���Ϊ��״�ṹ�ľ��壬�þ���Ϊʯī��ʯī���ڻ���;��壬���ڵ�̼ԭ��֮���Թ��ۼ����ϣ������֮���Է��»������ϣ���������С�Ļ�Ϊ6��̼ԭ���γɵĻ���ÿ��Cԭ���γ�3�����ۼ���ÿ��Cԭ��Ϊ3�������ã�����ݡ���̯�����У�6��1/3=2����������ÿ����С������2��ԭ�ӣ��ʴ�Ϊ��C60�����ʯ��8�����ۼ������»�����2��
(4). ��. B��NԪ�أ�N2��2��Nԭ��֮����3�����õ��Ӷ����ϣ�N2�ĵ���ʽΪ��![]() ����CO2�����У�Cԭ�Ӻ�2��Oԭ��֮��ֱ���2�����õ��Ӷ����ϣ�CO2�ĽṹʽΪ��O=C=O���ʴ�Ϊ��
����CO2�����У�Cԭ�Ӻ�2��Oԭ��֮��ֱ���2�����õ��Ӷ����ϣ�CO2�ĽṹʽΪ��O=C=O���ʴ�Ϊ��![]() ��O=C=O��
��O=C=O��
��. ��KMnO4������Һ����SO2����ʱ��MnO4������ԭΪMn2+����SO2��������SO42�������ݵ�ʧ�����غ��ԭ���غ㣬�÷�Ӧ�����ӷ���ʽΪ��5SO2+2MnO4��+2H2O�T2Mn2++5SO42��+4H+���ʴ�Ϊ��5SO2+2MnO4��+2H2O�T2Mn2++5SO42��+4H+��
(5). S��Zn�γɻ�����X�ľ�������S�ھ����ڲ���������Ϊ4��Zn�ڶ����������Zn��������Ϊ1/8��8+1/2��6=4������X�Ļ�ѧʽΪZnS�����ݾ���ʾ��ͼ��֪��ÿ��п������Χ������������ĸ������ӣ�ÿ����������Χ�����������4��п���ӣ�����S���ӵ���λ��Ϊ4�������߳�Ϊa cm������������Ϊ4��97NA�����Ծ���E���ܶ�Ϊ![]() =
=![]() = 388/(NAa3)���ʴ�Ϊ��ZnS��4��388/(NAa3)��
= 388/(NAa3)���ʴ�Ϊ��ZnS��4��388/(NAa3)��