题目内容
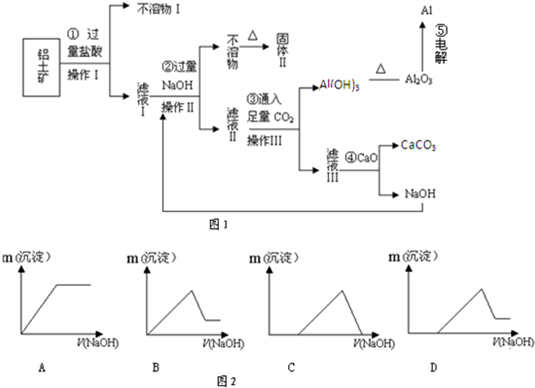
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的流程如下:

(1)滤液甲的主要成分是______
(2)写出反应 II 的离子方程式:______
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是______(填字母序号)
a.AlO2-或Al(OH)4- b.OH- C.SiO32-
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀部分消失.写出阴极的电极反应方程式______,沉淀部分消失的原因可用离子方程式表示为:______
(5)取(4)电解以后的溶液 10.0mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100mol?L-1 盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解.请画出生成沉淀的物质的量与加入盐酸体积的关系图.
解:(1)氧化铝为两性氧化物,与NaOH反应生成NaAlO2,SiO2为酸性氧化物,在加热条件下反应生成Na2SiO3,反应后所得滤液中含有偏铝酸钠、硅酸钠以及过量的氢氧化钠,
故答案为:NaOH、NaAl(OH)4(NaAlO2)、Na2SiO3[或氢氧化钠、铝酸钠(偏铝酸钠)、硅酸钠];
(2)根据反应产物可知,在滤液甲中通入二氧化碳气体,先与NaOH反应生成碳酸钠,后与偏铝酸钠反应生成氢氧化铝,硅酸钠没有反应,
反应的离子方程式分别为:CO2+2OH-═CO32-+H2O,CO2+3H2O+2AlO2-═2Al(OH)3↓+2H2O-+CO32-,
故答案为:CO2+2OH-═CO32-+H2O,CO2+3H2O+2AlO2-═2Al(OH)3↓+2H2O-+CO32-;
(3)三种混合液中,最先结合 H+离子的是OH-离子,由反应Ⅱ可知,AlO2-离子较SiO32-离子先结合 H+离子生成Al(OH)3,
故答案为:bac;
(4)滤液甲中加入过量盐酸反应生成氯化铝,电解时阳极反应为4OH--4e-═2H2O+O2↑,阴极反应为2H2O+2e-═2OH-+H2↑,
阴极上还发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O 等反应,
故答案为:2H2O+2e-═2OH-+H2↑;Al(OH)3+OH-═Al(OH)4- 或Al(OH)3+OH-═AlO2-+2H2O;
(5)电解后溶液中只含有两种等物质的量浓度的碱性溶质,应为NaOH和NaAlO2溶液,加入盐酸时先后发生反应:OH-+H+═H20,AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O,
设NaOH为xmol,则所需盐酸为x+x+3x=0.100mol?L-1×0.05L=0.005mol,x=0.001mol,以此画出图象,
故答案为: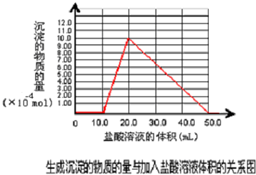
分析:(1)氧化铝为两性氧化物,与NaOH反应生成NaAlO2,SiO2为酸性氧化物,在加热条件下反应生成Na2SiO3,以此分析反应产物;
(2)根据反应产物可知,在滤液甲中通入二氧化碳气体,先与NaOH反应生成碳酸钠,后与偏铝酸钠反应生成氢氧化铝,硅酸钠没有反应,以此书写反应的离子方程式;
(3)三种混合液中,最先结合 H+离子的是OH-离子,由反应Ⅱ可知,AlO2-离子较SiO32-离子先结合 H+离子生成Al(OH)3;
(4)根据溶液中离子组成和溶液中离子的放电顺序判断反应的离子方程式;
(5)电解后溶液中只含有两种等物质的量浓度的碱性溶质,应为NaOH和NaAlO2溶液,加入盐酸时先后发生反应:OH-+H+═H20,AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O,
设NaOH为xmol,则所需盐酸为x+x+3x=0.100mol?L-1×0.05L=0.005mol,x=0.001mol,以此画出图象.
点评:本题考查镁和铝的重要化合物,题目难度中等,注意把握物质的重要性质.
故答案为:NaOH、NaAl(OH)4(NaAlO2)、Na2SiO3[或氢氧化钠、铝酸钠(偏铝酸钠)、硅酸钠];
(2)根据反应产物可知,在滤液甲中通入二氧化碳气体,先与NaOH反应生成碳酸钠,后与偏铝酸钠反应生成氢氧化铝,硅酸钠没有反应,
反应的离子方程式分别为:CO2+2OH-═CO32-+H2O,CO2+3H2O+2AlO2-═2Al(OH)3↓+2H2O-+CO32-,
故答案为:CO2+2OH-═CO32-+H2O,CO2+3H2O+2AlO2-═2Al(OH)3↓+2H2O-+CO32-;
(3)三种混合液中,最先结合 H+离子的是OH-离子,由反应Ⅱ可知,AlO2-离子较SiO32-离子先结合 H+离子生成Al(OH)3,
故答案为:bac;
(4)滤液甲中加入过量盐酸反应生成氯化铝,电解时阳极反应为4OH--4e-═2H2O+O2↑,阴极反应为2H2O+2e-═2OH-+H2↑,
阴极上还发生Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O 等反应,
故答案为:2H2O+2e-═2OH-+H2↑;Al(OH)3+OH-═Al(OH)4- 或Al(OH)3+OH-═AlO2-+2H2O;
(5)电解后溶液中只含有两种等物质的量浓度的碱性溶质,应为NaOH和NaAlO2溶液,加入盐酸时先后发生反应:OH-+H+═H20,AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O,
设NaOH为xmol,则所需盐酸为x+x+3x=0.100mol?L-1×0.05L=0.005mol,x=0.001mol,以此画出图象,
故答案为:

分析:(1)氧化铝为两性氧化物,与NaOH反应生成NaAlO2,SiO2为酸性氧化物,在加热条件下反应生成Na2SiO3,以此分析反应产物;
(2)根据反应产物可知,在滤液甲中通入二氧化碳气体,先与NaOH反应生成碳酸钠,后与偏铝酸钠反应生成氢氧化铝,硅酸钠没有反应,以此书写反应的离子方程式;
(3)三种混合液中,最先结合 H+离子的是OH-离子,由反应Ⅱ可知,AlO2-离子较SiO32-离子先结合 H+离子生成Al(OH)3;
(4)根据溶液中离子组成和溶液中离子的放电顺序判断反应的离子方程式;
(5)电解后溶液中只含有两种等物质的量浓度的碱性溶质,应为NaOH和NaAlO2溶液,加入盐酸时先后发生反应:OH-+H+═H20,AlO2-+H++H2O═Al(OH)3↓,Al(OH)3+3H+═Al3++3H2O,
设NaOH为xmol,则所需盐酸为x+x+3x=0.100mol?L-1×0.05L=0.005mol,x=0.001mol,以此画出图象.
点评:本题考查镁和铝的重要化合物,题目难度中等,注意把握物质的重要性质.

练习册系列答案
相关题目
工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
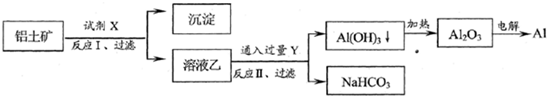
对上述流程中的判断正确的是( )

对上述流程中的判断正确的是( )
| A、试剂X为稀硫酸 | B、反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O→Al(OH)3↓+HCO3- | C、结合质子(H+)的能力由强到弱的顺序是:OH->AlO2->CO32- | D、Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |