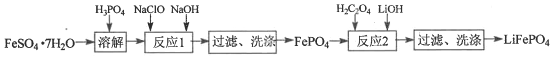
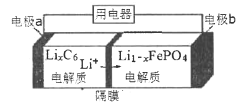
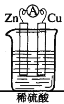
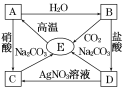
题目内容
【题目】已知存在离子反应3S+6OH-=2S2-+SO32-+3H2O,关于该反应的说法正确的是
A. 该反应属于复分解反应
B. 该反应氢氧根离子作氧化剂
C. 该反应中氧化剂与还原剂的质量为2∶1
D. 每生成2个S2-反应转移的电子数为6
【答案】C
【解析】
3S+6OH-=2S2-+SO32-+3H2O中,S元素的化合价由0升高为+4价,由0降低为-2价,以此来解答。
根据上述分析可知,
A. 3S+6OH-=2S2-+SO32-+3H2O中有元素化合价的升降,属于氧化还原反应,不属于复分解反应,A项错误;
B. 3S+6OH-=2S2-+SO32-+3H2O中,氢氧根离子中的氢元素与氧元素化合价均未发生变化,B项错误;
C. 硫元素化合价由0价升高为+4价,被氧化,氧化产物为K2SO3,硫元素由0价降低为2价,被还原,还原产物为K2S,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数可知,氧化剂和还原剂的物质的量之比为2:1,C项正确;
D. 每生成2个S2-反应转移的电子数2![]() (2-0)=4个,D项错误;
(2-0)=4个,D项错误;
答案选C。

练习册系列答案
相关题目