题目内容
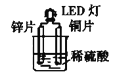
【题目】将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,

其正极反应式:_________________________;负极反应式: ____________;总反应方程式:_________________。若反应过程中有0.2mol电子发生转移,则生成的氢气在标准状况下的体积为_________。
【答案】2H++2e-=H2↑ Zn-2e-=Zn2+ Zn+2H+=Zn2++H2↑ 2.24L
【解析】
将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,活泼的金属作负极,发生氧化反应,不活泼的金属作正极,正极上发生还原反应,据此分析解答。
将锌片、铜片用导线连接后,置于稀硫酸中,形成原电池,原电池中锌是负极,铜是正极,正极上氢离子得电子生成氢气,电极反应式为:2H++2e-=H2↑,发生还原反应;负极上是金属锌失电子的氧化反应,电极反应式为:Zn-2e-=Zn2+,总反应等于正负极反应之和,即Zn+2H+=Zn2++H2↑;由正极的电极反应式2H++2e-=H2↑可知,反应过程中有0.2mol电子发生转移,则生成氢气0.1mol,其体积在标准状况下为0.1mol×22.4L/mol=2.24L,故答案为:2H++2e-=H2↑;Zn-2e-=Zn2+;Zn+2H+=Zn2++H2↑;2.24L。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
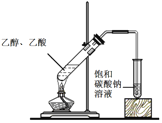
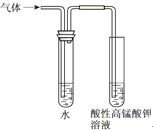
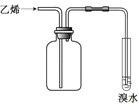
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D