题目内容
20.有四个系列同族元素形成的物质,101.3kP时测定它们的沸点(℃)如表所示:| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | a、b、c、d的化学式分别为Ne、Br2、HF、H2Se | |
| B. | 系列②中各物质均只有强氧化性 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>d>H2Te | |
| D. | 系列③中各物质对应物质水溶液的酸性和还原性均逐渐增强 |
分析 A、根据同主族元素的原子以及其单质分子、氢化物的知识来分析;
B、卤素单质均表现为较强的氧化性,也有还原性;
C、元素的非金属性越强,则氢化物的稳定性越强;
D、非金属性越强,氢化物的还原性越弱.
解答 解:A、He、Ne、Ar、Kr是同一只族元素的原子,根据递变顺序,可知a为Ne;F、Cl、Br、I属于同一主族元素的原子,且b应是单质形式,即为Br2,c为氢化物,即HF,d为H2Se,则a、b、c的化学式分别为Ne、Br2、HF、H2Se,故A正确;
B、系列②中各物质为卤素单质,卤素单质既有氧化性又有还原性,故B错误;
C、O、S、Se、Te的非金属性减弱,非金属性越弱,则氢化物的稳定性越弱,所以稳定性顺序为:H2O>H2S>d>H2Te,故C正确;
D、非金属性越强,氢化物的还原性越弱,F、Cl、Br、I非金属性减弱,则其氢化物的还原性增强,氢化物的酸性也增强,故D正确.
故选B.
点评 本题考查学生有关元素周期律的知识,注意把握同主族元素性质的变化规律,题目较简单.

练习册系列答案
相关题目
14.下列行为中不符合“建设低碳城市,应对气候变化”这一主题的是( )
| A. | 防止“地沟油”重上餐桌的方法之一是将其制成生物柴油,在汽油中添加20%的生物柴油可减少50%的CO2、70%的SO2的排放,空气毒性可降低90% | |
| B. | 北京市600个居住小区率先进行垃圾分类试点,以促进垃圾的综合利用 | |
| C. | 减少CO2的方法有可将CO2制成干冰用于人工降雨、用石灰水吸收CO2、将CO2制成甲醇、种植树木吸收CO2等 | |
| D. | 限制化学发展,关停化工企业,消除污染源头 |
8.家蝇的雌性信息素可用芥酸(来自菜籽油)与羧酸X在浓NaOH溶液中进行阳极氧化得到.电解总反应式为:C21H41COOH+X+4NaOH→C23H46+2Na2CO3+2H2O+H2↑
芥酸 雌性信息素
则下列说法不正确的是( )
芥酸 雌性信息素
则下列说法不正确的是( )
| A. | X只有1种结构 | |
| B. | 雌性信息素可能是烯烃,会使溴水褪色 | |
| C. | 电解的阳极反应式为:C21H41COOH+X+2H2O-2e-→C23H46+2CO32-+6H+ | |
| D. | 阴极的还原产物为H2 |
15.常温下,某NH4Cl溶液的pH=4,下列说法中正确的是( )
①溶液中c(H+)>c(OH-);
②由水电离产生的c(H+)约为10-10mol/L;
③溶液中离子浓度关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
④在纯水中加入该NH4Cl溶液,水的电离被抑制.
①溶液中c(H+)>c(OH-);
②由水电离产生的c(H+)约为10-10mol/L;
③溶液中离子浓度关系为c(Cl-)>c(NH4+)>c(H+)>c(OH-);
④在纯水中加入该NH4Cl溶液,水的电离被抑制.
| A. | ①② | B. | ①③ | C. | ①④ | D. | ①②③④ |
5.下列说法不正确的是( )
| A. | 生物质能的利用主要有以下几种方式:直接燃烧、生物化学转换和热化学转换 | |
| B. | 在人类研究物质微观结构的过程中,光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器先后得到了使用 | |
| C. | 能源可分为一次能源和二次能源,化学电源也可分为一次电池和二次电池 | |
| D. | 碰撞理论和过渡态理论是常用的反应速率理论,其中过渡态理论可解释温度、催化剂等对反应速率的影响 |
9.化学与资源、环境、生活关系密切,下列说法正确的是( )
| A. | 硅的性质较稳定,在自然界中存在游离态的硅 | |
| B. | 陶瓷、水泥、玻璃、金刚砂均为传统无机非金属材料 | |
| C. | 水泥、普通玻璃的制备均要用到石灰石 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液无影响 |
10.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| B. | 采用加热方法消毒的目的是使蛋白质变性而杀灭细菌 | |
| C. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| D. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 |

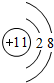 ,甲的化学式Na2S2O4
,甲的化学式Na2S2O4