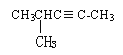��Ŀ����
����Ŀ��X��Y��ZΪ������Ԫ�أ�Xԭ�ӵ�����������Z��Y��������֮�ͣ�Z��Yλ��ͬһ���ڣ�YԪ���γ���̬�⻯��ˮ��Һ�ʼ��ԣ��ǽ���Z��һ�ֹ��嵥�ʿɵ��硣�ش��������⣺
(1)Y�����ڱ��е�λ���ǵ�_____���ڡ���____�壬��ԭ�ӽṹʾ��ͼΪ_______.Y��Z֮���γɵĻ�ѧ������___________(�����Ӽ��ۼ�)��
(2) X��Y��Z����Ԫ����ԭ�Ӱ뾶������_______(��Ԫ�ط���)��X���ʼȿ������ᷴӦ���ֿ���������������Һ������������Ϊ________(�����ʽ)����������Y���ʷ�Ӧ�Ļ�ѧ����ʽ______��
(3)Z�����������ĵ���ʽΪ_________________��
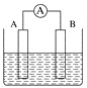
���𰸡��� ��A 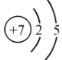 ���ۼ� Al H2 N2+3H2
���ۼ� Al H2 N2+3H2![]() 2NH3
2NH3 ![]()
��������
X��Y��ZΪ������Ԫ�أ�Xԭ�ӵ�����������Z��Y��������֮�ͣ�Z��Yλ��ͬһ���ڣ���Xλ�ڵ������ڣ�Y��Zλ�ڵڶ����ڣ�YԪ���γ���̬�⻯��ˮ��Һ�ʼ��ԣ���YΪNԪ�أ��ǽ���Z��һ�ֹ��嵥�ʿɵ��磬��ZΪCԪ�أ���XΪAlԪ�أ��ݴ˷������
��������������XΪAlԪ�أ�YΪNԪ�أ�ZΪCԪ�ء�
(1)YΪNԪ�أ��˵����Ϊ7�������ڱ���λ�ڵڶ����ڣ�����A�壬ԭ�ӽṹʾ��ͼΪ�� ��Y��ZΪN��C���ǽ���Ԫ���γɵĻ�����Ϊ���ۻ�����γɵĻ�ѧ�����ڹ��ۼ����ʴ�Ϊ��������A��
��Y��ZΪN��C���ǽ���Ԫ���γɵĻ�����Ϊ���ۻ�����γɵĻ�ѧ�����ڹ��ۼ����ʴ�Ϊ��������A�� �����ۼ���
�����ۼ���
(2)���Ӳ���Խ�࣬�뾶Խ���Ӳ�����ͬ���˵����Խ�뾶ԽС��X��Y��Z����Ԫ����ԭ�Ӱ뾶������Alԭ�ӣ������ʼȿ������ᷴӦ���ֿ���������������Һ����Ӧ�������������������͵�����ҵ�������ϳɰ�����Ӧ�Ļ�ѧ����ʽΪ��N2+3H2 ![]() 2NH3���ʴ�Ϊ��Al��H2��N2+3H2
2NH3���ʴ�Ϊ��Al��H2��N2+3H2![]() 2NH3��
2NH3��
(3)Z�����������Ϊ������̼�����ڹ��ۻ����̼ԭ�ӷֱ��������ԭ���γ�̼��˫��������ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�