题目内容
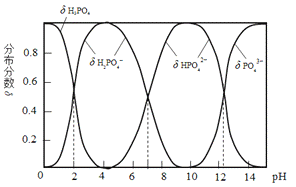
【题目】磷酸(H3PO4)是一种中强酸,常温下,H3PO4水溶液中含磷微粒的分布分数(平衡时某微粒的浓度占各含磷微粒总浓度的分数)与pH的关系如图,下列说法正确的是( )

A.H3PO4的电离方程式为:H3PO4![]() 3H++PO43-
3H++PO43-
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4-、HPO42-、PO43-
C.滴加NaOH溶液至pH=7,溶液中c(Na+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)
D.滴加少量Na2CO3溶液,3Na2CO3+2H3PO4=2Na3PO4+3H2O+3CO2↑
【答案】C
【解析】
从图中可以看出,随着pH的不断增大,溶质由H3PO4逐渐转化为H2PO4-、HPO42-、PO43-,但不管pH的大小如何,溶液中同时存在H3PO4、H2PO4-、HPO42-、PO43-。
A.H3PO4为多元弱酸,电离应分步进行,电离方程式为:H3PO4![]() H++H2PO4-,A错误;
H++H2PO4-,A错误;
B.pH=2时,溶液中大量存在的微粒有:H3PO4、H2PO4-,B错误;
C.滴加NaOH溶液至pH=7,依据电荷守恒,溶液中c(Na+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-),C正确;
D.滴加少量Na2CO3溶液,发生反应为Na2CO3+2H3PO4=2NaH2PO4+H2O+CO2↑,D错误;
故选C。

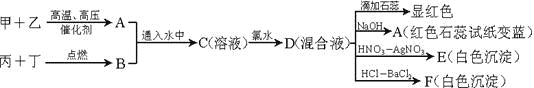
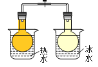
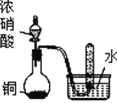
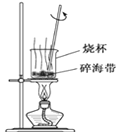
【题目】下列关于各装置与其对应的实验目的或得到的实验结论的说法中正确的是( )
选项 | A | B | C | D |
实验装置 |
探究温度对平衡2NO2 |
|
|
|
目的或结论 | 探究温度对平衡2NO2 | 试管中收集到无色气体,说明铜与浓硝酸的反应产物是NO | 海带提碘时,用上述装置灼烧海带 | 除去HCl气体中混有的少量Cl2 |
A.AB.BC.CD.D
【题目】污水处理是保护环境的需要,是每家企业应尽的义务。
已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
(1)还原法:在酸性介质中用FeSO4等将+6价铬还原成+3价铬。
具体流程如下:
![]()
有关离子完全沉淀的pH如下表:
有关离子 | Fe2+ | Fe3+ | Cr3+ |
完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
①写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式_____。
②还原+6价铬还可选用以下的试剂_____(填序号)。
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
③在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
在操作②中调节pH应分2次进行,第1次应先调节溶液的pH范围约在____(填序号)最佳,第2次应调节溶液的pH范围约在____(填序号)最佳。
A.3~4 B.6~8 C.10~11 D.12~14
用于调节溶液pH的最佳试剂为:____(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2 D.NaOH
(2)电解法:将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
④写出阴极的电极反应式_____。
⑤电解法中加入氯化钠的作用是_____。