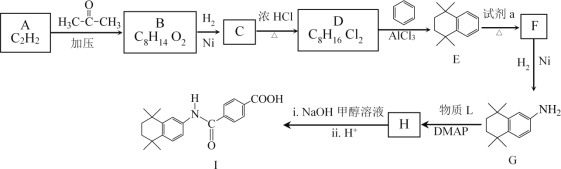
题目内容
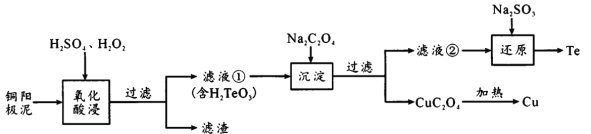
【题目】锂离子电池正极材料需要纯度较高的硫酸锰,目前工业硫酸锰中杂质(钙、镁、铁等)含量高,利用下图流程可制取纯度较高的硫酸锰溶液。

反应①使杂质生成氟化物的沉淀,对反应①前后的杂质含量检测结果(以350g/LMnSO4计)如下:
杂质 | 净化前/g | 净化后/g | 去除率/% |
Fe2+、Fe3+ | 0.001275 | 0.001275 | ﹣ |
Ca2+ | 0.490000 | 0.021510 | 95.61 |
Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)滤渣x中含有的物质是_____。
(2)试分析钙镁去除结果不同的原因:_____。
(3)在滤液中加入KMnO4可以将Fe2+氧化为Fe3+,同时生成Mn2+.该反应的离子方程式为_____。
(4)已知:生成氢氧化物沉淀的pH
Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
开始沉淀时 | 6.3 | 1.5 | 8.3 |
完全沉淀时 | 8.3 | 2.8 | 9.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释流程中②的目的:_____。
(5)进一步研究表明,如果反应①后不过滤直接加入KMnO4,同时控制加入的量,反应后调节pH,然后再过滤,可以进一步提高钙镁的去除率.钙镁去除率提高的原因有如下假设:
假设I:Fe2+与生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假设II:Mn2+与反应生成的活性MnO2吸附了沉淀物。
选择适当的无机试剂,设计实验验证假设是否成立____________________。
(6)锂离子电池充放电过程中,锂离子在正极和负极之间来回移动,就像一把摇椅,称“摇椅式电池”。典型的锂离子电池工作原理如图所示。

①放电时Li+的移动方向从__________极到极_____(填“a”或“b”)。
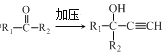
②已知电极总反应:LiCoO2+C![]() Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
【答案】CaF2、MgF2 CaF2比MgF2更难溶 ![]() +5Fe2++8H+=5Fe3++Mn2++4H2O 将Fe3+转化为Fe(OH)3达到分离铁元素与锰元素的目的 取工业硫酸锰废水,加入MnF2,将所得样品分成两份,其中一份加入Fe(OH)3胶体,另一份加入活性MnO2,分别检测Ca2+、Mg2+的去除率,若去除率提高(大于95.61%、90.04%),则说明假设成立 b a Li1﹣xCoO2+xLi++xe-=LiCoO2
+5Fe2++8H+=5Fe3++Mn2++4H2O 将Fe3+转化为Fe(OH)3达到分离铁元素与锰元素的目的 取工业硫酸锰废水,加入MnF2,将所得样品分成两份,其中一份加入Fe(OH)3胶体,另一份加入活性MnO2,分别检测Ca2+、Mg2+的去除率,若去除率提高(大于95.61%、90.04%),则说明假设成立 b a Li1﹣xCoO2+xLi++xe-=LiCoO2
【解析】
工业硫酸锰中杂质(钙、镁、铁等)含量高,90°C加入水中搅拌,加入MnF2反应生成CaF2、MgF2沉淀,滤液中加入高锰酸钾溶液氧化亚铁离子生成铁离子,调节溶液pH除去铁离子分离铁离子和锰离子,滤渣y为氢氧化铁。
(1)滤渣x中含有的物质是:CaF2、MgF2,
(2)根据表格可以看出,钙去除得较多,钙镁去除结果不同的原因是CaF2比MgF2更难溶;
(3)在滤液中加入KMnO4可以将Fe2+氧化为Fe3+,同时生成Mn2+,结合电子守恒和电荷守恒、原子守恒配平,该反应的离子方程式为:MnO4﹣+5Fe2++8H+5Fe3++Mn2++4H2O;
(4)根据表中数据,可知流程中②调节溶液pH使铁离子和锰离子分离,其目的是:将Fe3+转化为Fe(OH)3达到分离铁元素与锰元素的目的;
(5)对钙镁去除率提高的原因有如下假设:
假设Ⅰ:Fe2+与生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假设Ⅱ:Mn2+与反应生成的活性MnO2吸附了沉淀物.
设计实验验证假设是否成立:取工业硫酸锰溶液,加入MnF2,将所得样品分成两份,其中一份加入Fe(OH)3胶体,另一份加入活性MnO2,分别检测Ca2+、Mg2+的去除率,若去除率提高(大于95.61%、90.04%),则说明假设成立;
(6)①图中放电过程中电子从b流向a说明b为负极,a为正极,放电时Li+的移动方向从负极到正极即b极移向a电极;
②已知电极总反应:LiCoO2+C![]() Li1﹣xCoO2+CLix,则放电时正极的电极反应式为Li1﹣xCoO2+xLi++xe﹣=LiCoO2。
Li1﹣xCoO2+CLix,则放电时正极的电极反应式为Li1﹣xCoO2+xLi++xe﹣=LiCoO2。

【题目】I.研究金属腐蚀和防腐的原理很有现实意义。
(1)甲图为人教版教材中探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置实验,导管中液柱的上升缓慢,下列措施可以更快更清晰观察到水柱上升现象的有______(填序号)。
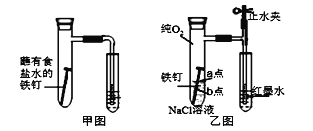
A.用纯氧气代替试管内空气 B.用酒精灯加热试管提高温度
C.将铁钉换成铁粉和炭粉混合粉末 D.换成更细的导管,水中滴加红墨水
(2)该小组将甲图装置改进成乙图装置并进行实验,导管中红墨水液柱高度随时间的变化如下表,根据数据判断腐蚀的速率随时间逐渐______(填“加快”、“不变”、“减慢”),你认为影响因素为_______。
时间/min | 1 | 3 | 5 | 7 | 9 |
液柱高度/cm | 0.8 | 2.1 | 3.0 | 3.7 | 4.2 |
(3)为探究铁钉腐蚀实验 a、b 两点所发生的反应,进行以下实验,请完成表格空白:
实验操作 | 实验现象 | 实验结论 |
向NaCl溶液中滴加2~3滴酚酞指示剂 | a点附近溶液出现红色 | a点电极反应为_____ |
然后再滴加2~3滴铁氰化钾溶液 | b点周围出现蓝色沉淀 | b点电极反应为 Fe -2e-=Fe2+ |
(4)设计下面装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化见图,从图中可分析,t1~t2之间主要发生_______腐蚀(填吸氧或析氢),原因_______。
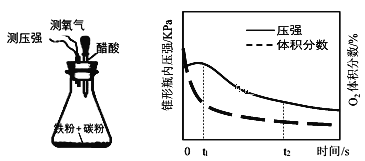
(5)金属阳极钝化是一种电化学防腐方法。将Fe作阳极置于H2SO4溶液中,一定条件下Fe钝化形成致密Fe3O4氧化膜,试写出该阳极电极反应式______。
II.已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为span>0.1000mol/L的KMnO4 标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在______(填“酸式”或“碱式”)滴定管中。
(2)到达滴定终点的标志是________。
(3)根据上述数据计算X=_______。
(4)误差分析(填偏高、偏低或无影响):若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;