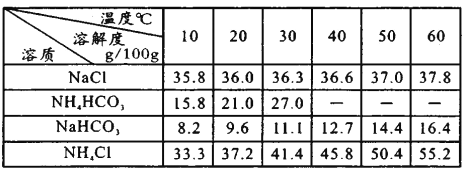
题目内容
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+6C(s)+2N2(g)═Si3N4(s)+6CO(g)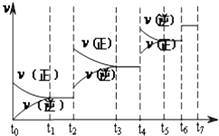
(1)该反应的平衡常数表达式为K=
(2)若知上述反应为放热反应,则其反应热△H0(填“>”、“<”或“=”);升高温度,其平衡常数值(填“增大”、“减小”或“不变”); 若已知CO生成速率为v(CO)=18molL﹣1min﹣1 , 则N2消耗速率为v(N2)=
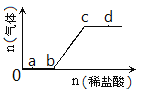
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是;
(4)图中表示平衡混合物中CO的含量最高的一段时间是 .
(5)已知:2H2(g)+O2(g)═2H2O(g);△H=﹣483.6kJmol﹣1;H2O(g)=H2O(l)△H=﹣44kJmol﹣1 , ;由此可知H2燃烧热化学方程式为 .
【答案】
(1)![]()
(2)<;减小;6mol?L﹣1?min﹣1
(3)增大压强或升高温度
(4)t3~t4
(5)H2(g)+ ![]() O2(g)═H2O(g);△H=﹣285.8?mol﹣1
O2(g)═H2O(g);△H=﹣285.8?mol﹣1
【解析】解:(1)可逆反应3SiO2(s)+6C(s)+2N2(g)Si3N4(s)+6CO(g)的平衡常数K= ![]() ; 所以答案是:K=
; 所以答案是:K= ![]() (2)对于放热反应,反应热△H<0;对于放热反应,温度升高,平衡逆向移动,K减小;已知CO生成速率为v(CO)=18molL﹣1min﹣1 , 根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)=
(2)对于放热反应,反应热△H<0;对于放热反应,温度升高,平衡逆向移动,K减小;已知CO生成速率为v(CO)=18molL﹣1min﹣1 , 根据速率之比等于化学计量数之比,则N2消耗速率为v(N2)= ![]() ×18molL﹣1min﹣1=6molL﹣1min﹣1;
×18molL﹣1min﹣1=6molL﹣1min﹣1;
所以答案是:<;减小; 6molL﹣1min﹣1(3)若不改变H2、CO的量,由图可知,t4时瞬间正、逆反应都增大,平衡向逆反应移动,改变条件为压缩体积增大压强,由(2)已知反应为放热反应,升高温度速率加快,反应逆向移动也可;
所以答案是:增大压强或升高温度 (4)t6时瞬间正、逆反应都增大,平衡不移动,故应是加入催化剂,t2时改变改变条件,平衡向正反应移动,在t3时重新到达平衡,t4时改变条件,平衡向逆反应移动,t5时由达平衡,故t3~t4平衡状态CO的含量最高;
所以答案是:t3~t4(5)已知:①2H2(g)+O2(g)═2H2O(g);△H=﹣483.6kJmol﹣1;
②H2O(g)=H2O(l)△H=﹣44kJmol﹣1 ,
根据燃烧热的热化学方程式的概念:1mol可燃物充分燃烧生成稳定氧化物的热化学方程式,由盖斯定律:
① ![]() +②可得:H2(g)+
+②可得:H2(g)+ ![]() O2(g)═H2O(g);△H=﹣285.8mol﹣1;
O2(g)═H2O(g);△H=﹣285.8mol﹣1;
所以答案是:H2(g)+ ![]() O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1
O2(g)═H2O(l);△H=﹣285.8 kJmol﹣1
【考点精析】根据题目的已知条件,利用反应热和焓变和反应速率的定量表示方法的相关知识可以得到问题的答案,需要掌握在化学反应中放出或吸收的热量,通常叫反应热;反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t.