��Ŀ����
����Ŀ����ҺM�к���MgCl2��KCl��AlCl3��ijС������ͼ��ʾ���̶�����д����Ի�ýϴ�����AlCl3��Һ����֪:AlO2-+CO2+2H2O=Al(OH)3��+HCO3-,��ش�:
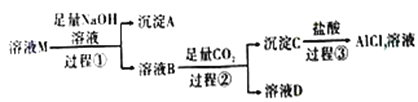
��1������A�Ļ�ѧʽΪ_______����������Al3+������Ӧ�����ӷ���ʽΪ_______��
��2�����������е�����������Һ_____(������������������)�ð�ˮ���棬ԭ����_______��
��3����ҺB�д������ڵ���������______����������Ӧ�����ӷ���ʽΪ_______��
���𰸡� Mg(OH)2 Al3++4OH-=AlO2-+2H2O ���� Al3+�백ˮ��Ӧ����Al(OH)3��,Al(OH)3�����백ˮ������Ӧ,�Ӷ����ܽ�Al(OH)3��Mg(OH)2�ֿ� K+��Na+ Al(OH)3+3H+=Al3++3H2O
����������ҺM������������������Һ��Ӧ����AΪMg(OH)2���õ�����ҺB�к���NaAlO2��KCl��NaCl��������NaOH����ҺB�������Ķ�����̼��Ӧ�õ�����CΪAl(OH)3����ҺD�к���KCl��NaCl��NaHCO3������C�����ᷴӦ����AlCl3��ˮ������1������A�Ļ�ѧʽΪMg(OH)2����������Al3+�����������������з�����Ӧ����ƫ�����ƣ���Ӧ�����ӷ���ʽΪAl3++4OH-=AlO2-+2H2O����2�����������е�����������Һ�����ð�ˮ���棬ԭ����Al3+�백ˮ��Ӧ����Al(OH)3��,Al(OH)3�����백ˮ������Ӧ,�Ӷ����ܽ�Al(OH)3��Mg(OH)2�ֿ�����3����ҺB�к���NaAlO2��KCl��NaCl��������NaOH���ʺ��д������ڵ���������K+��Na+�����������������������ᣬ��Ӧ�����ӷ���ʽΪAl(OH)3+3H+=Al3++3H2O��

 ȫ�Ų��Ծ�ϵ�д�
ȫ�Ų��Ծ�ϵ�д� ���100��1�ž�ϵ�д�
���100��1�ž�ϵ�д�