题目内容
【题目】将一定质量的镁和铝的混合物投入100ml盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.
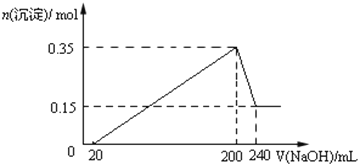
(1)原混合物中镁和铝的质量比为_______
(2)NaOH溶液的物质的量浓度为_______ molL﹣1
(3)生成的气体在标准状况下的体积为_______ L.
【答案】2:3510.08
【解析】
根据图像可知,加入NaOH溶液后并没有立即生成沉淀,这说明稀盐酸是过量的,所以有关离子方程式应该是:H++OH-=H2O、Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓、Al(OH)3+OH-=AlO2-+2H2O。根据图像可知,和Al(OH)3反应的NaOH溶液是240mL-200mL=40mL,则Al(OH)3的物质的量是0.35mol-0.15mol=0.20mol,Mg(OH)2是0.15mol,(1)根据原子守恒可知,镁和铝的总的质量分别是0.15mol×24g/mol=3.6g,0.2mol×27g/mol=5.4g,质量比为:3.6:5.4=2:3;(2)NaOH溶液的物质的量浓度是![]() =5mol/L;(3)根据镁和铝的物质的量可知:生成的氢气在标准状况下的体积为(0.15mol+
=5mol/L;(3)根据镁和铝的物质的量可知:生成的氢气在标准状况下的体积为(0.15mol+![]() 0.2mol)×22.4L/mol=10.08L。
0.2mol)×22.4L/mol=10.08L。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目