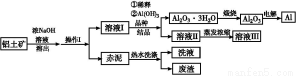
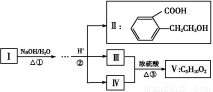
题目内容
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2p轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为 形;F2+的核外电子排布式为 。
(2)A分别与B、C形成的最简单化合物的稳定性B C(填“大于”或“小于”);A、C两元素可组成原子个数比为1∶1 的化合物,C元素的杂化类型为 。
(3)A2C所形成的晶体类型为 ;F单质形成的晶体类型为 。
(4)F元素氧化物的熔点比其硫化物的 (填“高”或“低”),请解释其原因
。
(5)E元素与C元素形成的化合物是 化合物,其晶体熔化时破坏的作用力是 ,晶体EC的熔点比晶体BC2的熔点 (填“高”或“低”)。
(1)直线 1s22s22p63s23p63d9或[Ar]3d9
(2)小于 sp3
(3)分子晶体 金属晶体
(4)高 CuO的晶格能大于CuS的晶格能
(5)离子 离子键 高
【解析】由题意可以判断出A为H元素,根据电子排布特点可以得出B为C元素,C为O元素。电负性最大的是非金属性最强的F元素,E为Ca元素,F应该是29号元素Cu。(1)CO2的空间构型为直线形,Cu2+电子排布式为1s22s22p63s23p63d9或[Ar]3d9。(2)氧元素非金属性比碳元素强,可知稳定性CH4<H2O,H2O2的O的杂化类型,根据VSEPR模型应该是四面体形,sp3杂化。(3)冰为分子晶体,Cu为金属晶体。(4)离子晶体 半径小于
半径小于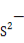 半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。
半径,故CuO的离子键强,晶格能较大,熔点较高。(5)CaO是离子化合物,晶体熔化时破坏离子键,CO2形成的晶体为分子晶体,熔点较低。

(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是
。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。
②M是含有 键的 分子(填“极性”或“非极性”)。
③N是一种易液化的气体,请简述其易液化的原因:
。
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。
⑤AB-中和B2分子的π键数目比为 。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
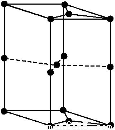
①E元素组成的单质的晶体堆积模型为 (填字母)。
a.简单立方堆积b.体心立方堆积
c.六方最密堆积d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。
③G2+的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 。
水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH=+131 kJ·mol-1
CO (g)+H2 (g) ΔH=+131 kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器 编号 | c(H2O) /mol·L-1 | c(CO) /mol·L-1 | c(H2) /mol·L-1 | v正、v逆比较 |
Ⅰ | 0.06 | 0.60 | 0.10 | v正=v逆 |
Ⅱ | 0.06 | 0.50 | 0.40 | ① |
Ⅲ | 0.12 | 0.40 | 0.80 | v正<v逆 |
Ⅳ | 0.12 | 0.30 | ② | v正=v逆 |
① ,② 。
在T温度下该反应的化学平衡常数为 。
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。
CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。