题目内容
19.某化学学习小组对铝与酸和碱的反应进行探究,过程如下.实验Ⅰ:
(1)取形状、大小均相同的铝丝分别与等体积的、pH相同的盐酸、稀硫酸反应,随反应进行,盐酸中生成气体的速率明显比硫酸中生成气体的速率快,对此原因,你认为合理的猜测是下列的bc(填写相应的字母).
a.盐酸的物质的量浓度大于硫酸的物质的量浓度 b.Cl-能促进此反应的进行
c.SO42-能抑制此反应的进行 d.硫酸使铝发生钝化
(2)为了探究反应速率不同的原因,请你根据所提供的药品,填写实验方案中的空白部分.
药品:氯化铝固体、硫酸铝固体、硫酸铜固体、氯化铜固体、6mol/L盐酸、3mol/L硫酸、18.4mol/L硫酸、5mol/L硝酸.
方案:取两支试管,首先同时分别加入形状、大小均相同的铝丝和等体积的3mol/LH2SO4(填写相应的试剂,下同),然后再向其中的一支试管中加入适量的氯化钠固体(或6mol/LHCl、硫酸钠固体)固体并振荡使固体溶解,观察实验现象.
实验探究:略.
实验Ⅱ:
取足量的形状、质量均相同的铝丝分别与等体积的6mol/L的盐酸、6mol/L氢氧化钠溶液反应,待反应停止后取出剩余的铝丝洗净、干燥、称量,剩余铝丝的质量关系是前者大于后者(填“大于”或“小于”或“等于”);观察反应后的液体,发现铝与盐酸反应后所得的液体是黑色浑浊的,试管底部有少量黑色沉淀,对此现象,同学们进行了如下探究:
(1)提出猜想
同学们查找资料后获得如下信息:工业上用电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,所以得到的氧化铝中可能还含有微量的氧化铁和二氧化硅两种杂质,据此,同学们提出如下猜想:
猜想1:此黑色固体是铁单质,可能是电解得到的铝与杂质反应生成的,相应的化学反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
猜想2:此黑色固体是硅单质,是电解得到的铝与二氧化硅反应生成的;
猜想3:此黑色固体是铝单质,是铝与盐酸反应时因反应过快而变成粉末分散到溶液中;
猜想4:此黑色固体可能是上述若干种单质组成的混合物.
(2)设计实验方案并完成相关实验:
为了探究少量黑色沉淀的成分,将反应后所得的液体进行过滤、、洗涤(填基本操作),分别取少量固体置于两支试管中,完成下列实验:
①向其中的一支试管中加入足量的稀盐酸,观察固体是否溶解.实验时发现固体完全溶解,证明猜想2一定不正确(填“1”、“2”、“3”、“4”).
②向另一试管中加入足量的氢氧化钠溶液,观察固体是否溶解.实验时发现固体完全溶解,证明猜想1一定不正确(填“1”、“2”、“3”、“4”).
(3)得出结论
综合实验①②的现象,可推知猜想3(填“1”、“2”、“3”、“4”)是正确的,固体溶解在氢氧化钠溶液中的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 实验I:比较盐酸和稀硫酸的不同点进行猜测;取酸和具有和酸不同离子的盐进行实验比较分析;
实验II:根据反应方程式判断;
(1)根据铝热反应写出反应方程式;
(2)根据实验现象证明猜想;
(3)根据实验不同现象判断正误并写出氧化铝和氢氧化钠反应的离子方程式.
解答 解:实验I:(1)取形状、大小均相同的铝丝分别与等体积的、PH相同的盐酸、稀硫酸反应,不同点是盐酸中含有氯离子,硫酸中含有硫酸根离子,所以猜测是氯离子促进反应,硫酸根离子抑制反应,
故选bc;
(2)选取酸,然后向酸中加入含有不同阴离子的盐并振荡使固体溶解,观察实验现象,从而确定影响因素,
故答案为:3mol/LH2SO4、氯化钠固体(或6mol/LHCl、硫酸钠固体);
实验II:由反应2Al+6HCl=2AlCl3+H2↑ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,
消耗相同物质的量的盐酸和氢氧化钠,加盐酸溶液的试管中参加反应的铝少,剩余的铝多,
故答案为:大于;
(1)在高温条件下,铝和氧化铁反应生成铁和氧化铝,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(2)为了探究少量黑色沉淀的成分,将反应后所得的液体进行过滤、洗涤,分别取少量固体置于两支试管中,
故答案为:过滤、洗涤;
①向其中的一支试管中加入足量的稀盐酸,实验时发现固体完全溶解,说明固体都是金属单质,所以证明猜想 2一定不正确,
故答案为:2;
②向另一试管中加入足量的氢氧化钠溶液,实验时发现固体完全溶解,铝和硅都能与氢氧化钠反应,根据实验现象证明猜想 1一定不正确,
故答案为:1;
(3)综合实验①②的现象,可推知猜想3是正确的;铝和氢氧化钠反应生成偏铝酸钠和氢气,
故答案为:3;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查了铝及其化合物性质的实验,难度不大,注意铝和氢氧化钠溶液反应方程式的书写,水作反应物参加反应.

①.CH3-CH=CH2和CH2=CH2的最简式相同
②.CH≡CH和C6H6含碳量相同
③.戊烯和丁烯互为同系物
④.能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ④ |
| A. | 氢气 | B. | 石油 | C. | 煤 | D. | 天然气 |
| A. | 三氧化二铝属于两性氧化物 | |
| B. | 用热的纯碱溶液洗涤沾有油污的物品时,发生的主要是化学变化 | |
| C. | 液氨、液氯、液态氯化氢都是非电解质 | |
| D. | 光导纤维的基本原料为SiO2 |
①同位素、同分异构体、同素异形体都是由于构成的微粒以不同的化学键结合引起的
②溶液显酸性是由于溶液中的c(H+)浓度大于10-7mol/L引起的
③原电池中电流的产生是发生氧化还原反应引起的
④胶体的丁达尔现象是由于胶体粒子的直径的特殊性引起的.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
①CO(g)+2H2(g)═CH3OH(g)△H1
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
(1)已知
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为a(填曲线标记字母),判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.
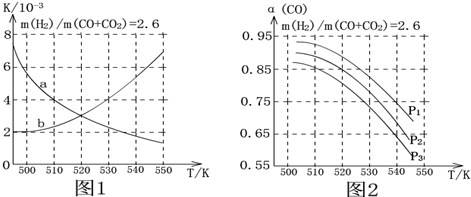
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示.α(CO)值随温度升高而减小(填“增大”或“减小”)原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小..图2中的压强由大到小为P1>P2>P3,判断理由是相同温度下,反应③前后气体分子数不变,压强改变不影响其平衡移动,反应①正反应为气体分子数减小的反应,增大压强,有利于平衡向正反应方向移动,CO的转化率增大,故增大压强有利于CO的转化率升高..
| A. | c(OH-)=c(R+)=0.01mol•L-1 | B. | c(R+)>c(H+) | ||
| C. | c(ROH)<c(R+) | D. | c(ROH)<c(OH-) |