题目内容
14.下列关于化学现象的解释正确的是( )①同位素、同分异构体、同素异形体都是由于构成的微粒以不同的化学键结合引起的
②溶液显酸性是由于溶液中的c(H+)浓度大于10-7mol/L引起的
③原电池中电流的产生是发生氧化还原反应引起的
④胶体的丁达尔现象是由于胶体粒子的直径的特殊性引起的.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 ①同位素、同分异构体、同素异形体的分析对象不同,与化学键无关;
②溶液酸碱性取决于氢离子与氢氧根离子的相对大小;
③原电池实质是氧化还原反应分别在两个电极上发生;
④胶体的丁达尔现象是胶体分散质对可见光的散射作用,与胶体分散质粒度有关.
解答 解:①同位素的分析对象为原子,同分异构体的分析对象为化合物,同素异形体的分析对象为单质,与化学键无关,故①错误;
②溶液显酸性是由于溶液中的c(H+)浓度大于c(OH-),故②错误;
③原电池实质是氧化还原反应分别在两个电极上发生,存在电子的移动,从而产生电流,故③正确;
④胶体的丁达尔现象是胶体分散质对可见光的散射作用,与胶体分散质粒度有关,故④正确;
故选:C.
点评 本题为综合题,考查了同位素、同素异形体、同分异构体的区别,胶体的性质,原电池工作原理,掌握基础是解题关键,题目难度不大.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
4.下列各组选项按照电解质→非电解质→单质→混合物顺序排列的一项是( )
| A. | 盐酸→SO3→石墨→Na2CO3•10H2O | B. | NaCl→NH3→铜→空气 | ||
| C. | 蔗糖→CuSO4→N2→Fe(OH)3胶体 | D. | KCl→CaO→液氯→石灰水 |
5.下列叙述正确的是( )
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液.
①一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路
②一定温度和压强下,气体体积主要由其分子的物质的量决定
③气体摩尔体积是指单位物质的量气体所占的体积,其单位是L
④在同温同体积时,气体的物质的量越大,则压强越大
⑤用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液.
| A. | ①②④ | B. | ①③⑤ | C. | ②③ | D. | ②④⑤ |
2.A、B、C、D、E为原子序数依次增大的短周期主族元素,A原子的最外层电子数为内层电子数的2倍,B原子的M电子层有1个电子,C的氢氧化物既能与强酸反应又能与强碱反应,D的最高正价和最低负价的代数和为4,E在同周期主族元素中原子半径最小.下列叙述错误的是( )
| A. | 元素C位于周期表中第三周期ⅢA族 | |
| B. | 熔融电解化合物CE3可制取单质C | |
| C. | D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | 化合物B2D2中既含离子键又含非极性共价键 |
6.下列叙述中正确的是( )
| A. | SiO2和NO2能与强碱溶液反应,都是酸性氧化物 | |
| B. | 不锈钢材料因含有铬、镍所以抗腐蚀性好 | |
| C. | 普通玻璃、钢化玻璃、玻璃钢都属于硅酸盐产品,水玻璃可用于木材防腐 | |
| D. | MgO和A12O3熔点较高都可以做耐火材料,都能和强碱溶液反应 |
3.下列叙述中,正确的是( )
| A. | 强电解质的导电性一定比弱电解质的导电性强 | |
| B. | 溶解度小的物质的导电性一定比溶解度大的物质的导电性弱 | |
| C. | 金属元素从化合态变为游离态时,该元素一定被还原 | |
| D. | 金属阳离子得电子多时氧化性强 |
4.下列有关化学用语的表示正确的是( )
| A. | 四氯化碳分子的电子式: | B. | 对硝基甲苯的结构简式: | ||
| C. | 羟基的电子式: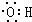 | D. | 乙醛的结构简式:CH3COH |