题目内容
【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。
【答案】(1)SiO2
(2)漏斗、玻璃棒、烧杯 D
(3)KSCN溶液(或其他合理答案)
(4)防止NH4HCO3分解,减少Fe2+的水解
(5)4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2
2Fe2O3 + 4CO2
(6)①2Fe2++H2O2+2H+=2Fe3++2H2O ; ②7b/10a
【解析】试题分析:(1)硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)酸浸后过滤,SiO2与酸不反应,所以SiO2为滤渣,滤液中含有的金属阳离子是Fe2+、Fe3+。(2) “步骤Ⅱ”中分离操作是过滤,所用的玻璃仪器有漏斗、玻璃棒、烧杯;调节PH加入的试剂要与氢离子反应,同时不能引入新杂质,步骤Ⅳ中应选用氨水调节溶液的pH。
(2)步骤Ⅲ要把Fe3+还原为Fe2+,检验步骤Ⅲ已经进行完全,即溶液不含Fe3+,使用试剂是KSCN溶液;(4)NH4HCO3受热易分解,高温会促进Fe2+水解,所以步骤Ⅴ的反应温度一般需控制在35℃以下。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2。
2Fe2O3 + 4CO2。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式2Fe2++H2O2+2H+=2Fe3++2H2O;
②产生沉淀,经过滤、洗涤、灼烧至固体恒重,得到的固体是Fe2O3,根据铁元素守恒,测得该样品中Fe元素的质量分数为![]() =7b/10a。
=7b/10a。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】下列物质的描述和相关知识均正确的是( )
物质及变化 | 描述 | 相关知识 | |
A | 碘化钾溶液滴到土豆片上 | 变蓝色 | 土豆片含淀粉 |
B | 煤的气化 | 化学变化 | 主要反应是碳与水生成水煤气等 |
C | 乙烯和苯 | 都能使溴水褪色 | 分子中含有相同的碳碳双键 |
D | 蔗糖和麦芽糖 | 多糖 | 二者互为同分异构体 |
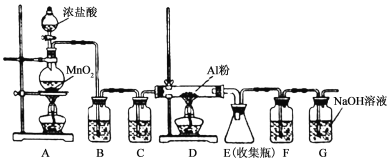
【题目】某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验,请回答下列问题:

(1)装置甲中盛放浓硝酸的仪器A的名称是 ,仪器B中发生反应的化学方程式为
(2)完成下面表格中的空白
装置编号 | 实验现象 | 反应的化学方程式 | NO2表现的化学性质 |
乙 | 淡黄色固体变白色 | Na2O2+2NO2=2NaNO3 | |
丙 | 氧化性 |
(3)取下装置丙中的试管C,向其中滴加足量的Na2SO3溶液,溶液颜色褪去,该过程中发生反应的离子方程式为 。
反应后的溶液中主要含有SO32—、SO42—、I—等阴离子,请填写鉴定SO32—、SO42—和I—的实验报告。
限选试剂:2mol/LHCl、1mol/LH2SO4、1mol/LBaCl2、1mol/LBa(NO3)2、CCl4、新制饱和溴水、新制饱和氯水。
编号 | 实验操作 | 预期现象和结论 |
步骤1 | 取少量待测液于试管A中,加入几滴新制得饱和溴水,振荡 | ,证明待测液中含有SO32— |
步骤2 | ||
步骤3 | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,振荡、静置后观察颜色 | ,证明待测液中含有I- |