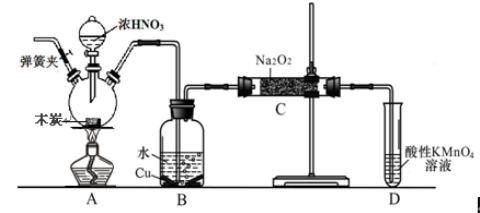
题目内容
【题目】二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃。用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如下图所示:
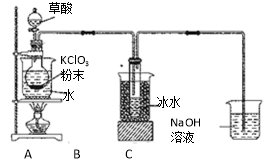
⑴ 装置A中还应安装的玻璃仪器是 ,装置B用冰水浴的原因是 。
⑵ 装置A中反应产物有K2CO3、ClO2和CO2等,请写出该反应的化学方程式: 。
⑶ ①实验过程中,装置C中少量的ClO2与NaOH溶液反应产生两种钠盐,且物质的量之比为1:1,其中一种为NaClO2,写出装置C中生成这两种钠盐的离子方程式: 。
②饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,在温度高于38℃时析出晶体NaClO2。请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:a.____________;b_____________;c.洗涤;d.干燥。
⑷ 还可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备ClO2更受欢迎,其主要原因是 。
【答案】⑴ 温度计,常温下ClO2为气态;
⑵ 2KClO3+H2C2O4 ![]() K2CO3+CO2↑+2ClO2↑+H2O;
K2CO3+CO2↑+2ClO2↑+H2O;
⑶ ①2ClO2+2OH==ClO2+ClO3+H2O;②蒸发结晶,趁热过滤;
⑷ H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2。
【解析】
试题分析:(1)根据信息,在60℃时反应可生成ClO2,因此控制水浴的温度,需要用温度计,测水浴的温度,常温下ClO2为气态,冰水的温度为0℃,做到ClO2的收集;(2)反应物为KClO3和草酸,产物为K2CO3、ClO2、CO2,根据化合价升降进行配平,则反应方程式为:2KClO3 + H2C2O4 ![]() K2CO3 + CO2↑ + 2ClO2↑ + H2O;(3)①其中盐为NaClO2,ClO2中Cl的价态由+4→+3价,因此有化合价升高,根据得失电子数目守恒,以及两种盐的物质的量之比为1:1,则ClO2中Cl的化合价也升高1价,即Cl由 + 4 → + 5价,为NaClO3,其反应离子方程式为:2ClO2 + 2OH- = ClO2- + CKO3- + H2O;②实验的目的是得到NaClO2,根据信息在温度高于38℃时析出晶体NaClO2,因此应蒸发结晶、趁热过滤;(4) H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2。
K2CO3 + CO2↑ + 2ClO2↑ + H2O;(3)①其中盐为NaClO2,ClO2中Cl的价态由+4→+3价,因此有化合价升高,根据得失电子数目守恒,以及两种盐的物质的量之比为1:1,则ClO2中Cl的化合价也升高1价,即Cl由 + 4 → + 5价,为NaClO3,其反应离子方程式为:2ClO2 + 2OH- = ClO2- + CKO3- + H2O;②实验的目的是得到NaClO2,根据信息在温度高于38℃时析出晶体NaClO2,因此应蒸发结晶、趁热过滤;(4) H2O2作还原剂时氧化产物为O2,而盐酸作还原剂时产生大量Cl2。

【题目】工业上利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2)为原料制备高档颜料——铁红(Fe2O3),具体生产流程如下:

试回答下列问题:
(1)硫铁矿烧渣用稀硫酸酸溶时的不溶物为 (填化学式)。
(2)实验室实现“步骤Ⅱ”中分离操作所用的玻璃仪器有 ;
步骤Ⅳ中应选用 试剂调节溶液的pH(填字母编号)。
A.稀硝酸 | B.氢氧化钠溶液 | C.高锰酸钾溶液 | D.氨水 |
(3)检验步骤Ⅲ已经进行完全的试剂是 。
(4)步骤Ⅴ的反应温度一般需控制在35℃以下,其目的是 。
(5)步骤Ⅵ在空气中煅烧发生反应的化学反应方程式为 。
(6)欲测定硫铁矿烧渣中Fe元素的质量分数,称取ag样品,充分“酸溶”、“水溶”后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再继续产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称得残留固体bg。
①写出加入足量的H2O2发生反应的离子反应方程式 ;
②测得该样品中Fe元素的质量分数为 。