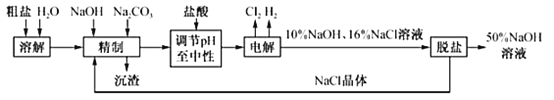
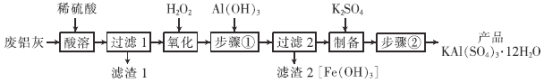
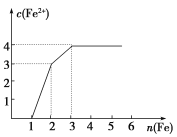
��Ŀ����
����Ŀ����һ�������½�0.01 molCH3COONa��0.005molHCl ����ˮ�����0.5 L�����Һ��
��1����Һ�й���________������
��2����Һ���������������ʵ���֮��һ������0.01 mol ��������____________��
��3����Һ��n ( CH3COO- ) + n ( OH- ) - n( H+ ) =_________mol��
�����������£�ȡŨ����ȵ�NaOH��HCl��Һ����3��2��������ͣ�������Һ��pH����12����ԭ��Һ��Ũ��Ϊ_________________ mol/L��
���𰸡�7 CH3COO- ��CH3COOH 0.005 0.05
��������
��1��0.01molCH3COONa��0.005molHCl����ˮ�õ�0.005molCH3COONa��0.005molCH3COOH��0.005molNaCl��CH3COONa��NaClΪǿ����ʣ�CH3COOHΪ������ʣ�
��2�����������غ���������
��3�����ݵ���غ������Һ��n��CH3COO-��+n��OH-��-n��H+����ֵ��
��������Ӧ����ҺpH=12����NaOH����������c��OH-��=![]()
��������Ϻ���������ԭ��Һ��Ũ�ȡ�
��һ����1��0.01molCH3COONa��0.005molHCl����ˮ�õ�0.005molCH3COONa��0.005molCH3COOH��0.005molNaCl��CH3COONa��NaClΪǿ����ʣ�CH3COOHΪ������ʣ�����Һ�д��ڵ�����Ϊ��Na+��H+��Cl-��OH-��CH3COO-�����ڵķ���Ϊ��H2O��CH3COOH��������7�ֲ�ͬ������
��ȷ�𰸣�7��
��2�����ݴ�����غ��֪��CH3COOH��CH3COO-�����������ʵ���֮�͵���0.01mol��
��ȷ�𰸣�CH3COOH��CH3COO-��
��3�����ݵ���غ��֪��n��Na+��+n��H+��=n��Cl-��+n��OH-��+n��CH3COO-����
����n��CH3COO-��+n��OH-��-n��H+��=n��Na+��-n��Cl-��=0.01mol-0.005mol=0.005mol��
��ȷ�𰸣�0.005��
��������NaOH xmol/L,HCLxmol/L���������NaOH 3V L,HCL 2VL
��Һ��PH����12 ��C��OH-��=Kw/C(H+)=1��10-14/10-12=0.01mol/L
�� x��3V -x��2V��/5V=0.01�õ�x=0.05mol/L��
��ȷ�𰸣�0.05��