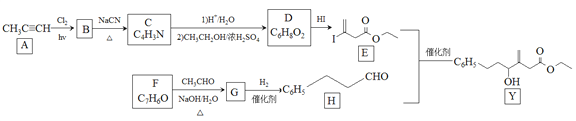
题目内容
【题目】工业食盐中含Ca2+、Mg2+等杂质,某厂电解饱和食盐水制取NaOH溶液的工艺流程如图所示,回答下列问题:
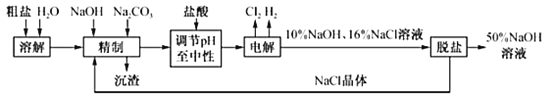
(1)“精制”过程中发生反应的离子方程式为_____
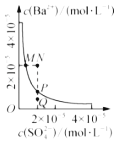
(2)若粗盐中SO42﹣含量也较高,沉淀剂可以是_____(填字母)且要在试剂Na2CO3之_____加入(填“前”或“后”)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)在电解过程中,产生H2的电极与外接电源的_____极相连;溶液pH增大的区域是_____(填“阳极区”或“阴极区”)。
(4)烧碱和氯气是电解饱和食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_____(填写计算表达式和结果且结果保留两位小数)。
【答案】Ca2++CO32﹣═CaCO3↓、Mg2++2OH﹣═Mg(OH)2↓ ac 前 负 阴极区 1.13
【解析】
(1)“精制”过程中加入NaOH和Na2CO3,为了除去溶液中的Ca2+和Mg2+, Ca2+以碳酸钙的形式除去,Mg2+以Mg(OH)2的形式除去,根据电荷守恒可以写出方程式,答案为Ca2++CO32﹣═CaCO3↓、Mg2++2OH﹣═Mg(OH)2↓;
(2)SO42﹣可以用Ba2+除去,但是不能引入新的杂志,阴离子可以选择OH﹣和Cl-,不能选NO3-,除杂过程中,试剂要加过量,Ba2+过量后是新的杂质,所以也要除去,恰好使用Na2CO3将其除去,因此要在Na2CO3之前加Ba2+;答案为ac 前;
(3)水得到电子,生成氢气,剩下了OH-,电极方程式2H2O+2e-=H2↑+2OH-,得电子的一极为阴极,与外电源的负极相连,阴极区pH变大;答案为负 阴极区;
(4)电解饱和食盐水的反应方程式2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,根据方程式,生成2molNaOH 80g,生成1molCl2 71g,则
2NaOH+Cl2↑+H2↑,根据方程式,生成2molNaOH 80g,生成1molCl2 71g,则![]() ,取两位小数,答案为1.13。
,取两位小数,答案为1.13。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】化学反应原理是研究和学习化学的重要依据。回答下列问题:
(1)已知氢气的燃烧热△H=﹣285.5kJmol﹣1,则电解水的热化学方程式为_____
(2)在298K、101kPa下,2SO2(g)+O2(g)2SO3(g)△H=﹣198kJmol﹣1,则相同条件下,2mol SO2和 1 mol O2充分反应,最终放出的热量_____198kJ(填“大于”“小于或“等于”);该反应的平衡常数表达式K=_____。
(3)25℃时,下表为一些难溶电解质的相关数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
开始沉淀时的pH | 5.8 | 4.1 | 2.0 |
完全沉淀时的pH | 8.3 | 6.4 | 3.2 |
常温下,除去酸性CuCl2溶液中含有的少量FeCl2,其操作步骤为:
①应先加入_____(填试剂名称),发生的离子反应方程式为_____
②再加入CuO,调节溶液的pH在_____范围内,使溶液中的Fe3+转化为Fe(OH)3沉淀,过滤。