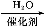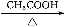题目内容
NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2的反应方程是:MnO4—+NO2—+  Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )
Mn2++NO3—+H2O(未配平)。下列叙述中正确的是( )
A.该反应中NO2—被还原
B.反应过程中溶液的pH减小
C.生成1 mol NaNO3需消耗0.4 mol KMnO4
D. 中的粒子是OH-
C
【解析】先根据得失电子守恒写出:2MnO4—+5NO2—+  2Mn2++5NO3—+ H2O,再根据电荷守恒,确定出反应物的 中应为阳离子,再结合生成物H2O,知 中应为6H+,D错,根据原子守恒,则H2O的系数为3。该反应配平后的反应式为:2MnO4—+5NO2—+6H+
2Mn2++5NO3—+ H2O,再根据电荷守恒,确定出反应物的 中应为阳离子,再结合生成物H2O,知 中应为6H+,D错,根据原子守恒,则H2O的系数为3。该反应配平后的反应式为:2MnO4—+5NO2—+6H+ 2Mn2++5NO3—+3H2O。反应中MnO4—是氧化剂,NO2—是还原剂,A错;反应消耗H+,则pH增大,B错;由配平后的离子方程式知,C正确。
2Mn2++5NO3—+3H2O。反应中MnO4—是氧化剂,NO2—是还原剂,A错;反应消耗H+,则pH增大,B错;由配平后的离子方程式知,C正确。

练习册系列答案
相关题目