题目内容
下列表述中正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.由C(石墨,s) C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,金刚石比石墨稳定
C(金刚石,s) ΔH=+11.9 kJ·mol-1可知,金刚石比石墨稳定
C.同温同压下,H2(g)+Cl2(g) 2HCl(g)在光照和点燃条件的ΔH不同
2HCl(g)在光照和点燃条件的ΔH不同
D.任何一个化学变化都伴随着能量的变化
D
【解析】燃烧热的定义是1 mol可燃物完全燃烧生成稳定氧化物的热效应,产物水应为液态且燃烧热的单位是kJ·mol-1,故A项错误;根据石墨到金刚石吸热知,石墨的能量低,能量越低越稳定,石墨比金刚石稳定,B项错误;ΔH=生成物总焓-反应物总焓,知ΔH与反应条件无关,C项错误;任何一个化学反应生成物总焓不等于反应物总焓,总有能量变化,故D项正确。

 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案电镀污泥中含有Cr(OH)3、Al2O3、ZnO、CuO、NiO等物质,工业上通过“中温焙烧—钠氧化法”回收Na2Cr2O7等物质。

已知:在Na2CrO4溶液中含有少量NaAlO2、Na2ZnO2等物质
(1)水浸后的溶液呈 性(填“酸”、“碱”或“中”)。
(2)完成氧化焙烧过程中生成Na2CrO4的化学方程式。
Cr(OH)3+ Na2CO3+ 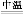 Na2CrO4+ CO2+
Na2CrO4+ CO2+
(3)滤渣Ⅱ的主要成分有Zn(OH)2、 。
(4)“系列操作”中为:继续加入H2SO4, ,冷却结晶,过滤。继续加入H2SO4目的是 。
已知:①除去滤渣II后,溶液中存在如下反应:
2CrO42—+2H+ Cr2O72—+H2O
Cr2O72—+H2O
②Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表
温度 溶解度 化学式 | 20 ℃ | 60 ℃ | 100 ℃ |
Na2SO4 | 19.5 | 45.3 | 42.5 |
Na2Cr2O7 | 183 | 269 | 415 |
Na2CrO4 | 84 | 115 | 126 |
(5)工业上还可以在水浸过滤后的溶液(Na2CrO4)加入适量H2SO4,用石墨作电极电解生产金属铬,写出生成铬的电极反应方程式 。