题目内容
下列有关盐类水解的说法不正确的是( )
| A、盐类水解过程破坏了纯水的电离平衡 |
| B、盐类水解反应是酸碱中和反应的逆反应 |
| C、盐类水解的结果使溶液不一定呈中性 |
| D、Na2S溶液中c(Na+)是c(S2-)的2倍 |
考点:影响盐类水解程度的主要因素
专题:盐类的水解专题
分析:A、盐类水解结合水电离生成的氢离子或氢氧根离子,则盐类水解促进水的电离,破坏水的电离平衡;
B、盐类水解反应是酸碱中和反应的逆反应;
C、盐的水解会导致有的盐溶液显示酸碱性;
D、Na2S溶液中c(S2-)是弱离子要结合水电离出的氢离子变成HS-和H2S,所以c(Na+)是c(S2-)的2倍多.
B、盐类水解反应是酸碱中和反应的逆反应;
C、盐的水解会导致有的盐溶液显示酸碱性;
D、Na2S溶液中c(S2-)是弱离子要结合水电离出的氢离子变成HS-和H2S,所以c(Na+)是c(S2-)的2倍多.
解答:
解:A、盐类水解结合水电离生成的氢离子或氢氧根离子,则盐类水解促进水的电离,破坏水的电离平衡,故A正确;
B、盐类水解反应是酸碱中和反应的逆反应,故B正确;
C、盐的水解会导致有的盐溶液显示酸碱性,但不一定呈中性,故C正确;
D、Na2S溶液中c(S2-)是弱离子要结合水电离出的氢离子变成HS-和H2S,所以c(Na+)是c(S2-)的2倍多,故D错误;故选D.
B、盐类水解反应是酸碱中和反应的逆反应,故B正确;
C、盐的水解会导致有的盐溶液显示酸碱性,但不一定呈中性,故C正确;
D、Na2S溶液中c(S2-)是弱离子要结合水电离出的氢离子变成HS-和H2S,所以c(Na+)是c(S2-)的2倍多,故D错误;故选D.
点评:本题考查学生盐的水解原理以及盐的电离知识,注意知识的梳理和归纳是解题的关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对甲基苯甲酸(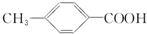 )是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为:
)是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为: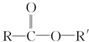 ,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )
,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )
 )是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为:
)是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为: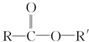 ,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )
,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )| A、3种 | B、4种 | C、5种 | D、6种 |
下列说法正确的是( )
| A、油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应 |
| B、蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素 |
| C、棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| D、氨基酸、淀粉均属于高分子化合物 |
下列说法正确的是( )
| A、油脂和蛋白质均属于高分子化合物 |
| B、二氧化硅是太阳能电池的主要材料 |
| C、Na、C、S都能直接与氧气反应,生成两种相应的氧化物 |
| D、蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体 |
对于反应N2+3H2?2NH3,下列说法处于化学平衡状态的是( )
①υ(N2生成)=υ(N2消耗)
②N2、H2、NH3的分子数之比为1:3:2
③单位时间内生成2mol NH3,同时消耗1mol N2
④N2、H2、NH3的物质的量不再发生变化.
①υ(N2生成)=υ(N2消耗)
②N2、H2、NH3的分子数之比为1:3:2
③单位时间内生成2mol NH3,同时消耗1mol N2
④N2、H2、NH3的物质的量不再发生变化.
| A、①④ | B、②③ |
| C、②③④ | D、①③④ |
关于氧化还原反应,下列说法不正确的是( )
| A、一定存在着元素化合价变化 |
| B、一定有单质参加反应 |
| C、氧化反应和还原反应同时发生 |
| D、一定存在着电子转移 |
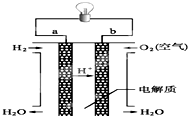 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.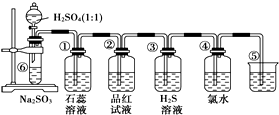 如图是实验室制备SO2并验证SO2某些性质的装置图.试回答
如图是实验室制备SO2并验证SO2某些性质的装置图.试回答