题目内容
下列说法正确的是( )
| A、沸点:H2O>H2S>H2Se>H2Te |
| B、稳定性:SiH4>PH3>H2S>HCl |
| C、熔点:SiC>KCl>I2>CO2 |
| D、沸点:CH4>SiH4>GeH4>SnH4 |
考点:非金属在元素周期表中的位置及其性质递变的规律,分子间作用力对物质的状态等方面的影响
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A、氢化物的相对分子质量越大,则沸点越高,含有氢键的沸点较高;
B、非金属性越强,其氢化物的稳定性越强;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体;
D、氢化物的相对分子质量越大,则沸点越高.
B、非金属性越强,其氢化物的稳定性越强;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体;
D、氢化物的相对分子质量越大,则沸点越高.
解答:
解:A、氢化物的相对分子质量越大,则沸点越高,含有氢键的沸点较高,沸点:H2O>H2Te>H2Se>H2S,故A错误;
B、非金属性越强,其氢化物的稳定性越强,非金属性:Cl>S>P>Si,则稳定性:SiH4<PH3<H2S<HCl,故B错误;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体,SiC属于原子晶体,KCl属于离子晶体,碘单质和二氧化碳属于分子晶体,碘单质常温为固体,二氧化碳为气体,所以熔点:SiC>KCl>I2>CO2,故C正确;
D、氢化物的相对分子质量越大,则沸点越高,所以沸点:CH4<SiH4<GeH4<SnH4,故D错误;
故选C.
B、非金属性越强,其氢化物的稳定性越强,非金属性:Cl>S>P>Si,则稳定性:SiH4<PH3<H2S<HCl,故B错误;
C、熔点的一般规律:原子晶体>离子晶体>分子晶体,SiC属于原子晶体,KCl属于离子晶体,碘单质和二氧化碳属于分子晶体,碘单质常温为固体,二氧化碳为气体,所以熔点:SiC>KCl>I2>CO2,故C正确;
D、氢化物的相对分子质量越大,则沸点越高,所以沸点:CH4<SiH4<GeH4<SnH4,故D错误;
故选C.
点评:本题考查了元素周期律,明确同周期、同主族元素性质的递变规律是关键,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
对于反应N2+3H2?2NH3,下列说法处于化学平衡状态的是( )
①υ(N2生成)=υ(N2消耗)
②N2、H2、NH3的分子数之比为1:3:2
③单位时间内生成2mol NH3,同时消耗1mol N2
④N2、H2、NH3的物质的量不再发生变化.
①υ(N2生成)=υ(N2消耗)
②N2、H2、NH3的分子数之比为1:3:2
③单位时间内生成2mol NH3,同时消耗1mol N2
④N2、H2、NH3的物质的量不再发生变化.
| A、①④ | B、②③ |
| C、②③④ | D、①③④ |
某烃1mol最多能和2mol HBr加成反应,其所得的产物又能跟8mol Br2发生取代反应,最后得到一种只含碳、溴两种元素的化合物,则原烃为( )
| A、C2H2 |
| B、C3H4 |
| C、C3H6 |
| D、C4H6 |
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
| A、Na+、K+、Cl-、SO42- |
| B、Cu2+、Fe2+、NO3-、SO42- |
| C、Na+、Ca2+、Cl-、ClO- |
| D、K+、NH4+、Cl-、SO42- |
冶金工业上常用电解熔融MgCl2而不用电解MgO的方法制取镁,其原因是( )
| A、熔融的MgO不导电 |
| B、MgO分子间作用力很大 |
| C、MgO熔点高 |
| D、MgO属原子晶体 |
关于氧化还原反应,下列说法不正确的是( )
| A、一定存在着元素化合价变化 |
| B、一定有单质参加反应 |
| C、氧化反应和还原反应同时发生 |
| D、一定存在着电子转移 |
在盐类发生水解的过程中,下列说法正确的是( )
| A、盐的水解不属于离子反应 |
| B、溶液的pH发生改变 |
| C、水的电离程度逐渐增大 |
| D、没有中和反应发生 |
下列画有横线的反应物在反应中不能完全消耗的是( )
| A、将含少量CO2的CO通入足量Na2O2的试管并不断用电火花引燃 |
| B、向等物质的量的干冰和CaO的混合物中加几滴水 |
| C、将1molCu置于含2molH2SO4的浓硫酸中加热 |
| D、在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量的CO2 |
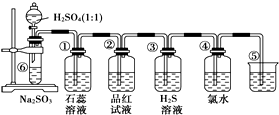 如图是实验室制备SO2并验证SO2某些性质的装置图.试回答
如图是实验室制备SO2并验证SO2某些性质的装置图.试回答