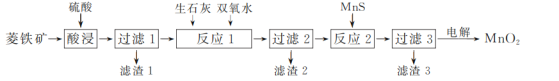
题目内容
【题目】铁及其化合物是日常生活生产中应用广泛的材料,钛铁合金具有吸氢特性,在制造以氢为能源的热泵和蓄电池等方面有广阔的应用前景。请回答下列问题:
(l)基态铁原子的价电子轨道表达式(电子排布图)为____________________________;在基态Ti2+中,电子占据的最高能层具有的原子轨道数为____________。
(2)铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+___Fe3+(填“大于”或“小于”),原因是___________。
(3)纳米氧化铁能催化火箭推进剂NH4ClO4的分解,NH4+的结构式为(标出配位键)______________。
(4)金属钛采用六方最密堆积的方式形成晶体。则金属钛晶胞的俯视图为___________。
A.  B.
B.  C.
C.  D.
D. 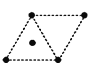
(5)氮化钛熔点高,硬度大,具有典型的NaCl型晶体结构,其晶胞结构如图所示。
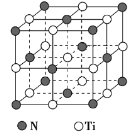
①设氮化钛晶体中Ti原子与跟它最邻近的N原子之间的距离为r,则与该Ti原子最邻近的Ti的数目为__________;
Ti原子与跟它次邻近的N原子之间的距离为____________。
②已知在氮化钛晶体中Ti原子的半径为a pm,N原子的半径为b pm,它们在晶体中是紧密接触的,则在氮化钛晶体中原子的空间利用率为____________。(用a、b表示)
③碳氮化钛化合物在汽车制造和航天航空领域有广泛的应用,其结构是用碳原子代替氮化钛晶胞顶点的氮原子,则这种碳氮化钛化合物的化学式为_____________________。
【答案】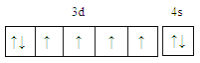 9 小于 Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,Fe3+ 的3d能级为半满状态较稳定
9 小于 Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,Fe3+ 的3d能级为半满状态较稳定 ![]() D 12
D 12 ![]() r
r 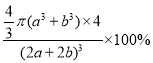 Ti4CN3
Ti4CN3
【解析】
(1)(1)Fe元素的核电荷数为26,基态原子电子排布式为1s22s22p63s23p63d64s2;基态Ti2+核外有20个电子,最高能层为M层;
(2)Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5;
(3)NH4+为正四面体结构,结构中含有极性键和配位键;
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞结构为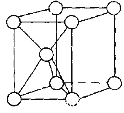 ;
;
(5)①有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子;由晶胞的截图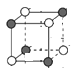 可知,顶点Ti原子与小立方体顶点N原子最邻近,与体对角线的N原子次近邻;
可知,顶点Ti原子与小立方体顶点N原子最邻近,与体对角线的N原子次近邻;
②氮化钛晶胞为面心立方密堆积,晶胞中N原子位于顶点和面心上,Ti位于棱边上和体内,利用均摊法计算;
③利用均摊法计算;
(1)Fe元素的核电荷数为26,基态原子电子排布式为1s22s22p63s23p63d64s2,则价电子轨道表达式(电子排布图)为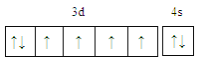 ;基态Ti2+核外有20个电子,电子排布式为1s22s22p63s23p63d2,最高能层为M层,电子占据的M层具有的原子轨道数为9,故答案为:
;基态Ti2+核外有20个电子,电子排布式为1s22s22p63s23p63d2,最高能层为M层,电子占据的M层具有的原子轨道数为9,故答案为: ;9;
;9;
(2)Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,能级为半满状态较稳定,则稳定性Fe2+小于Fe3+,故答案为:小于;Fe2+的价电子排布式为3d6,Fe3+的价电子排布式为3d5,Fe3+ 的3d能级为半满状态,较稳定;
(3)NH4+为正四面体结构,结构中含有极性键和配位键,氮原子和氢离子间的配位键是氮原子提供孤对电子,氢离子提供空轨道,其结构式为: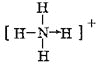 ,故答案为:
,故答案为: ;
;
(4)金属钛采用六方最密堆积的方式形成晶体,其晶胞结构为 ,则金属钛晶胞的俯视图为
,则金属钛晶胞的俯视图为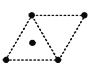 ,故答案为:D;
,故答案为:D;
(5)①根据氮化钛晶体可知,有一个Ti原子位于体心,在三维坐标中,体心Ti原子可以形成3个面,每一个形成的面上有4个Ti原子,则该Ti原子最邻近的Ti的数目为3×4=12个;由晶胞的截图 可知,顶点Ti原子与小立方体顶点N原子最邻近,与体对角线的N原子次近邻,Ti原子与跟它最邻近的N原子之间的距离为r,则跟它次邻近的N原子之间的距离为
可知,顶点Ti原子与小立方体顶点N原子最邻近,与体对角线的N原子次近邻,Ti原子与跟它最邻近的N原子之间的距离为r,则跟它次邻近的N原子之间的距离为![]() =
=![]() r,故答案为:12;
r,故答案为:12;![]() r;
r;
②氮化钛晶胞为面心立方密堆积,晶胞中N原子位于顶点和面心上,Ti位于棱边上和体内,每个晶胞中含有的N原子个数为8×![]() +6×
+6×![]() =4,含有的Ti原子个数为 12×
=4,含有的Ti原子个数为 12×![]() +1=4,N原子和Ti原子的体积之和为
+1=4,N原子和Ti原子的体积之和为![]() π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在氮化钛晶体中原子的空间利用率为
π(a+b)3×4 pm3,晶胞的边长(2a+2b)pm,体积为(2a+2b)3pm3,则在氮化钛晶体中原子的空间利用率为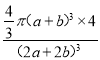 ×100%,故答案为:
×100%,故答案为: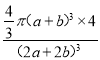 ×100%;
×100%;
③利用均摊法可知,晶胞中含有碳原子数为8×![]() =1,含有氮原子数为6××
=1,含有氮原子数为6××![]() =3,含有的Ti原子个数为 12×
=3,含有的Ti原子个数为 12×![]() +1=4,则碳氮化钛化合物的化学式为Ti4CN3,故答案为:Ti4CN3。
+1=4,则碳氮化钛化合物的化学式为Ti4CN3,故答案为:Ti4CN3。

 名校课堂系列答案
名校课堂系列答案