题目内容
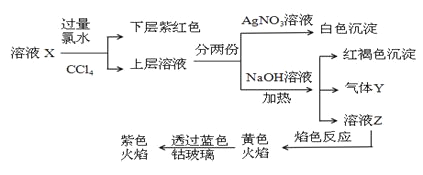
【题目】银系列产品广泛地应用于化工、电子电锁、材料和工业催化等领域,对含银废料中贵金属银的综合回收具有重要的研究意义。一种对银粉和 AgNO3 生产过程中产生的含银废料进行综合回收的工艺流程如图:
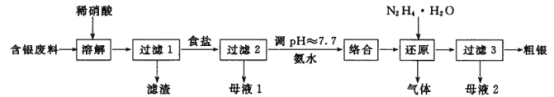
回答下列问题:
(1)“溶解”反应的化学方程式为 ______。稀硝酸能否用浓硫酸代替____(填“能”或“不能”),原因是______________。
(2)“过滤3”操作中用到的玻璃仪器是_____________。
(3)“络合”步骤中需要加氨水调pH≈7.7,生成的络合物为_____________。
(4)N2H4H2O称水合肼,具有强还原性和碱性。水合肼与硫酸反应生成正盐的化学式为_______。
(5)“还原”步骤中产生的气体可参与大气循环,该气体分子的电子式为_______。
(6)“母液 2”中溶质的化学式为______________。
(7)粗银经过烘干、焙烧、电解得到纯度99. 9% 的银。
①焙烧是在中频炉中进行 ,中频炉优点是加热升温速度快,氧化烧损仅为 0.5%, 在此焙烧目的是_______。
②电解时粗银做电极阳极,阴极为不锈钢板 ,电解液为 AgNO3 、HNO3 、KNO3 混合溶液,电解液中HNO3 和 KNO3 的作用分别是__________、_________。
【答案】3Ag+ 4HNO3 =3AgNO3 + NO↑+ 2H2O 不能 硫酸银覆盖在银的表面,过滤1后银和硫酸银一起随滤渣而除去 烧杯、玻璃棒、漏斗 Ag(NH3)2Cl N2H6SO4 ![]() NH4Cl 除去粗银中含有的杂质 调节电解液的pH 提高电解液的导电性
NH4Cl 除去粗银中含有的杂质 调节电解液的pH 提高电解液的导电性
【解析】
(1)“溶解”反应是银与稀硝酸反应生成硝酸银、NO和水;不能浓硫酸代替稀硝酸,因为硫酸银微溶;
(2)根据过滤操作作答;
(3)过滤2的固体为AgCl,加入氨水,生成Ag(NH3)2Cl;
(4)N2H4H2O具有碱性,与硫酸反应生成N2H6SO4;
(5)利用电子守恒、原子守恒结合题意,写出反应的化学方程式;
(6)根据(5)作答;
(7)①反应中有物质包裹,焙烧可除去;
②HNO3显酸性,可调节电解液的pH;KNO3 可提高电解液的导电性。
(1)“溶解”反应是银与稀硝酸反应生成硝酸银、NO和水,方程式为:3Ag+ 4HNO3 =3AgNO3 + NO↑+ 2H2O;不能浓硫酸代替稀硝酸,因为硫酸银微溶,覆盖在银的表面,过滤1后银和硫酸银一起随滤渣而除去,故答案为:3Ag+ 4HNO3 =3AgNO3 + NO↑+ 2H2O;不能;硫酸银覆盖在银的表面,过滤1后银和硫酸银一起随滤渣而除去;
(2)过滤操作要用的玻璃仪器有:烧杯、玻璃棒、漏斗,故答案为:烧杯、玻璃棒、漏斗;
(3)过滤2的固体为AgCl,加入氨水,发生络合反应生成Ag(NH3)2Cl,故答案为:Ag(NH3)2Cl;
(4)N2H4H2O具有碱性,与硫酸反应生成正盐为N2H6SO4,故答案为:N2H6SO4;
(5)水合肼具有还原性,其被Ag(NH3)2Cl氧化的方程式为N2H4·H2O+4Ag(NH3)2Cl=N2↑+4Ag↓+H2O+ 4NH4Cl,则产生的气体N2可参与大气循环,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(6)根据(5)可知,反应后溶液中存在NH4Cl,“母液2”中溶质的化学式为NH4Cl,故答案为:NH4Cl;
(7)①过滤后NH4Cl包裹在粗银中,焙烧可除去,故答案为:除去粗银中含有的杂质;
②HNO3显酸性,可调节电解液的pH;KNO3 可提高电解液的导电性,故答案为:调节电解液的pH;提高电解液的导电性。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案