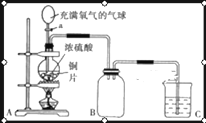
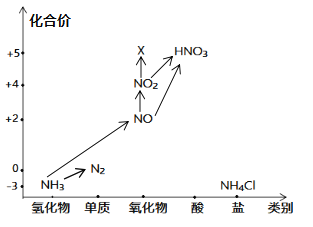
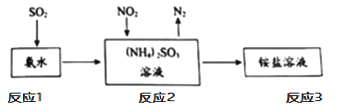
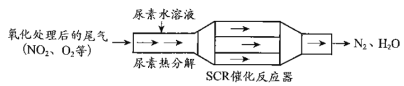
题目内容
【题目】海水中溴含量约为65mg·L-1,从海水中提取溴的工业流程如下:
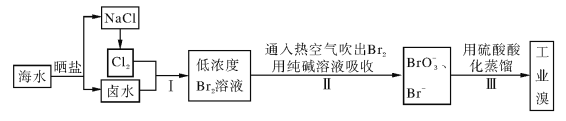
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是____。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:_____
![]() Br2+
Br2+![]() CO32-===
CO32-===![]() BrO3-+
BrO3-+![]() Br-+
Br-+![]() CO2↑
CO2↑
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。写出溴与二氧化硫水溶液反应的化学方程式:__________。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是_____。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
【答案】(1)富集(或浓缩)溴元素;(2)C;
(3)3 3 1 5 3
(4)SO2+Br2+2H2O===2HBr+H2SO4;(5)BD
【解析】
试题(1) 以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是富集(或浓缩)溴元素。(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的易挥发的性质。
(3) 根据电荷守恒、电子守恒平衡:3Br2+3CO===1BrO+5Br-+3CO2↑
(4)溴与二氧化硫水溶液反应的化学方程式:SO2+Br2+2H2O===2HBr+H2SO4。
(5)实验室分离溴还可以用溶剂萃取法,溴易溶于有机溶剂,可用四氯化碳、苯[来作溴的萃取剂;乙醇与水互溶,不能用乙醇作溴的萃取剂。

【题目】下列实验操作规范且能达到目的的是
目的 | 操作 | |
A. | 取20.00 mL盐酸 | 在50 mL酸式滴定管中装入盐酸,调整初始读数为30.00 mL后,将剩余盐酸放入锥形瓶 |
B. | 测定醋酸钠溶液pH | 用玻璃棒蘸取溶液,点在湿润的pH试纸上 |
C. | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
D. | 配制浓度为0.010 | 称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度 |
A. A B. B C. C D. D
【题目】下列除杂选用的试剂或操作方法正确的是
物质 | 杂质 | 除去杂质选用的试剂或操作方法 | |
A | KNO3溶液 | KOH | 加入适量氯化铁溶液,并过滤 |
B | FeSO4溶液 | CuSO4 | 加入过量铜粉,并过滤 |
C | H2 | CO2 | 先后通过盛有氢氧化钠溶液和浓硫酸的洗气瓶 |
D | 铁粉 | 铜粉 | 加入足量稀硫酸过滤 |
A.AB.BC.CD.D