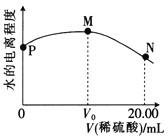
题目内容
【题目】下列反应的发生与沉淀溶解平衡或盐类水解平衡的移动无关的是
A. 盐酸与碳酸钙反应生成二氧化碳
B. 镁条与氯化铵溶液反应生成氢气
C. 硝酸银溶液与盐酸反应生成氯化银
D. 硫酸铝溶液和小苏打溶液反应生成二氧化碳
【答案】C
【解析】A项,CaCO3在溶液中存在溶解平衡:CaCO3(s)![]() Ca2+(aq)+CO32-(aq),盐酸电离的H+与CO32-结合,CO32-浓度减小,溶解平衡正向移动,生成CO2,与沉淀溶解平衡的移动有关;B项,NH4Cl溶液中存在水解平衡:NH4++H2O
Ca2+(aq)+CO32-(aq),盐酸电离的H+与CO32-结合,CO32-浓度减小,溶解平衡正向移动,生成CO2,与沉淀溶解平衡的移动有关;B项,NH4Cl溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+,Mg与H+反应生成Mg2+和H2,H+浓度减小,水解平衡正向移动,与盐类水解平衡的移动有关;C项,AgNO3与HCl发生复分解反应:Ag++Cl-=AgCl↓,与沉淀溶解平衡的移动无关;D项,Al2(SO4)3溶液中存在水解平衡:Al3++3H2O
NH3·H2O+H+,Mg与H+反应生成Mg2+和H2,H+浓度减小,水解平衡正向移动,与盐类水解平衡的移动有关;C项,AgNO3与HCl发生复分解反应:Ag++Cl-=AgCl↓,与沉淀溶解平衡的移动无关;D项,Al2(SO4)3溶液中存在水解平衡:Al3++3H2O![]() Al(OH)3+3H+,NaHCO3溶液中存在水解平衡:HCO3-+H2O
Al(OH)3+3H+,NaHCO3溶液中存在水解平衡:HCO3-+H2O![]() H2CO3+OH-,硫酸铝溶液和小苏打溶液混合由于H+与OH-结合成H2O,水解平衡都正向移动,最终水解趋于完全生成CO2,与盐类水解平衡的移动有关;答案选C。
H2CO3+OH-,硫酸铝溶液和小苏打溶液混合由于H+与OH-结合成H2O,水解平衡都正向移动,最终水解趋于完全生成CO2,与盐类水解平衡的移动有关;答案选C。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】某工厂的废液经测定其主要含有乙醇,此外还有丙酮、乙酸和乙酸乙酯.以上各物质的沸点如下:
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 77.06 | 78 | 117.9 |
现拟通过下列步骤回收乙醇和乙酸:
①向废液中加入甲溶液;②将混合液放入蒸馏器中缓缓加热;③收集温度在70℃~85℃之间的馏出物;④排出蒸馏器中的残液,冷却后向其中加入乙溶液(过量),然后再放入蒸馏器中进行蒸馏,收集馏出物.
可选用试剂:A.烧碱溶液 B.浓硫酸 C.饱和食盐水 D.浓盐酸
请回答下列问题:
(1)乙醇的沸点比丙酮沸点高的主要原因是 .
(2)加入甲溶液是 , (填A B C D序号),涉及到的反应方程式: .
(3)在70℃~85℃时馏出物的主要成分为 .
(4)在步骤④中加入过量的乙溶液是 . (填A B C D序号),
(5)最后蒸馏的温度控制在 .
(6)在蒸馏操作中,仪器选择及安装都正确的是:(填标号)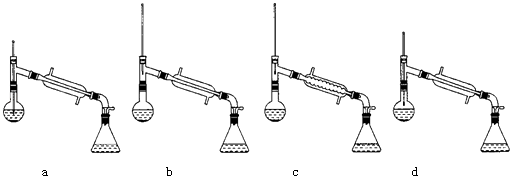
如果蒸馏前忘记加沸石,液体温度已接近沸点时,应该如何处理? .