题目内容
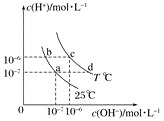
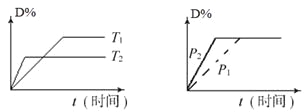
【题目】可逆反应mA(s)+n D(g)![]() pX(g)+qY(g)在反应过程中,其他条件不变,D的转化率和温度T或压强p关系如图所示(D﹪为D的转化率),下列叙述中正确的是
pX(g)+qY(g)在反应过程中,其他条件不变,D的转化率和温度T或压强p关系如图所示(D﹪为D的转化率),下列叙述中正确的是
A.正反应为放热反应
B.使用催化剂,D的物质的量减小
C.化学方程式系数m+n=p+q
D.增加物质A或D的用量,平衡均向右移动
【答案】A
【解析】
可逆反应,当其他条件一定时,温度越高,反应速率越大,达到平衡所用的时间越短.由图(1)可知T2>T1,温度越高,平衡时D的转化率越小,故此反应的正反应为放热反应;当其他条件一定时,压强越高,反应速率越大,达到平衡所用的时间越短,由图(2)可知p2>p1,压强越大,平衡时D的转化率相同,可知反应为气体物质的量不变的反应,即n=p+q。
A、正反应为放热反应,A正确;
B、使用催化剂,平衡不移动,B错误;
C、由上述分析可知,n=p+q,C错误;
D、增大固体物质的物质的量不能使平衡移动,A为固体,达到平衡后,增加A平衡不移动,D错误。
答案选A。

练习册系列答案
相关题目