题目内容
已知某元素+3价离子的电子排布为:1s22s22p63s23p63d5,该元素在周期表中的位置正确的是( )
A.第三周期第Ⅷ族, B.第四周期第ⅤA族,
C.第三周期第ⅤB族, D.第四周期第Ⅷ族
D
【解析】
试题分析:某元素+3价离子的电子排布为:1s22s22p63s23p63d5,说明该元素原子的核外电子数是26,为铁元素,位于元素周期表中第四周期第八族,答案选D。
考点:考查离子的核外电子排布与元素在周期表中位置的关系

下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① |
|
| |||||
2 |
|
|
| ② | ③ | ④ |
|
|
3 | ⑤ |
| ⑥ |
| ⑦ |
| ⑧ | ⑨ |
4 | ⑩ |
|
|
|
|
|
|
|
(1)写由上述元素组成的分子中电子总数为10的分子(至少两种): 。
(2)比较:②、③、④、⑤的第一电离能: > > > (写元素符号)。
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ;碱性最强的化合物的电子式是:
(4)具有两性的最高价氧化物是 (填化学式);写出其与氢氧化钠溶液反应的离子方程式: 。
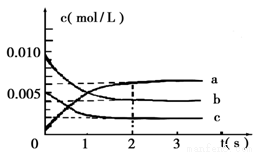
(5)下表为原子序数依次增大的短周期元素A~E的第一到第五电离能数据。
电离能I(eV)AB C D E
I111.313.65.27.66.0
I224.435.149.315.018.8
I347.954.971.680.128.4
I464.577.498.9109.2112.0
I5392.1113.9138.3141.3153.7
试回答:表中可能为非金属元素的是 (填字母);若D、E为同周期相邻元素,表中D比E的第一电离能略大,其原因是 。