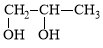题目内容
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义。
(1)合成氨的原理为:N2(g)+3H2 2NH3 △H= - 92.4kJ/mol
2NH3 △H= - 92.4kJ/mol
①将一定量的N2(g)和H2(g)放入1L的密闭容器中,在500℃、2×107Pa下达到平衡,平衡时测得N2为0.1 mol,H2为0.3 mol,NH3为0.1 mol。该条件下H2的转化率为 。
此温度下该反应的平衡常数K= 。
②欲提高H2的转化率,下列措施可行的是 。
a.向容器中按原比例再充入原料气
b.向容器中再充入惰性气体
c.改变反应的催化剂
d.液化生成物分离出氨
(2)在2L密闭容器中,800℃时反应2NO(g)+O2(g)  2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
2NO2(g) △H<0体系中,各成分浓度随时间的变化如图:
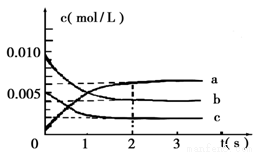
①用O2表示从0~2s内该反应的平均速率v=___________。
②能说明该反应已经达到平衡状态的是_________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
③为使该反应的反应速率增大,且平衡向正反应方向移动的是_________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
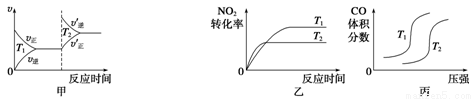
(3)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。4CO(g)+2NO2(g)  4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是______(填代号)。
(1)33.3% (2分) K=3.7(L/mol)2 或100/27(L/mol)2 (2分) ②ad(2分)
(2)① 1.5×10-3mol/(L·s) (2分) ②b c (2分) ③c(1分)
(3)乙 (1分)
【解析】
试题分析:⑴ ① N2(g) + 3H2 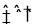 2NH3 △H=-92.4kJ/mol
2NH3 △H=-92.4kJ/mol
起始浓度:0.15mol/L 0.45mol/L 0
变化量: 0.05mol/L 0.15mol/L 0.1mol/L
平衡浓度:0.1mol/L 0.3mol/L 0.1mol/L
因此该条件下H2的转化率为: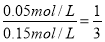
平衡常数为: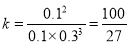
②a.向容器中按原比例再充入原料气,可以引入假想状态,让按原比例充入的原料气充入一个体积相等,温度相等的容器中与原来的达到等效平衡,然后将这两个容器等压下合并,此刊转化率不变,这时,将容器压缩至原来的体积,相当于增大压强,平衡向右移动,氢气转化率增大; b.向容器中再充入惰性气体,容器体积不变,各组分的浓度不变,平衡不发生移动,氢气的转化率是不变的;c.改变反应的催化剂,只能改变化学反应的速率,不能改变各种物质的转化率;d.液化生成物分离出氨,减小了生成物的浓度,平衡正向移动,增大了氢气的转化率。
⑵①从图中三条线的变化趋势经及变化量的大小,可知a线对应的是二氧化氮;b线对应的是一氧化氮;c线对应的是氧气。所以: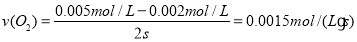
②a.v(NO2)=2v(O2) 这种关系是始终存在的,不能作为反应达到平衡的标志;b.容器内压强保持不变,表明容器内的各组分的总的分子数不变了,若正向移动,是分子总数减小的方向,若逆向移动,是分子总数增大的方向,因此,当容器内压强保持不变的时候,表明达到了平衡状态;c.v逆(NO)=2v正(O2):
①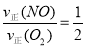 ,这个关系在反应中是始终存在的;若达到平衡状态,则有:②
,这个关系在反应中是始终存在的;若达到平衡状态,则有:②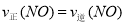 ,将②代入①可得:
,将②代入①可得: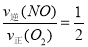 ,也就是v逆(NO)=2v正(O2),正确;d.容器内的密度保持不变,这是一个体积不变的气体之间的反应,不管反应到什么程度,容器内的密度始终保持不变,因此该选项不能作为反应达到平衡状态的标志。因此该题选bc。③a.及时分离出NO2气体,会使得反应速率减慢,错误;b.适当升高温度,反应速率加快,但反应逆向移动,错误;c.增大O2的浓度,反应速率加快,平衡逆向移动,正确;d.选择高效的催化剂,反应速率加快,但平衡不移动,错误。
,也就是v逆(NO)=2v正(O2),正确;d.容器内的密度保持不变,这是一个体积不变的气体之间的反应,不管反应到什么程度,容器内的密度始终保持不变,因此该选项不能作为反应达到平衡状态的标志。因此该题选bc。③a.及时分离出NO2气体,会使得反应速率减慢,错误;b.适当升高温度,反应速率加快,但反应逆向移动,错误;c.增大O2的浓度,反应速率加快,平衡逆向移动,正确;d.选择高效的催化剂,反应速率加快,但平衡不移动,错误。
⑶甲图中,在第一次达到平衡后,升高温度到T2,正逆反应速率都是增大的,因此甲错误;乙图中,遵循“先拐先平,数值大”,且在高温时,正向是放热的,升温平衡会逆向移动,使得二氧化氮的转化率减小。乙图正确;丙图中随着压强的增大,平衡正向移动,一氧化碳的转化率增大,但含量逐渐的降低。丙图错误。
考点:考查化学反应速率、化学平衡及其移动。

 53随堂测系列答案
53随堂测系列答案现有一瓶甲、乙的混合物,已知甲、乙属同系物,甲、乙某些性质如下:
物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 水溶性 |
甲 | C3H6O2 | -98 | 55.5 | 0.93 | 可溶 |
乙 | C4H8O2 | -84 | 87 | 0.90 | 可溶 |
根据物理性质,将混合物中甲、乙分离的最佳方法是( )
A.蒸馏 B.萃取 C.重结晶 D.分液