题目内容
过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。①称取
②另取
5CaC2O4+2KMnO4+8H2SO4![]() K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
(1)计算样品中的CaO2的质量分数。
(2)计算样品中的CaO2·xH2O的x值。
解:(1)2CaO2![]() 2CaO+O2↑
2CaO+O2↑
w(CaO2)=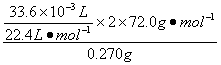 ×100%=80%
×100%=80%
(2)n(CaC2O4)=n(Ca2+)=31.0×10
其中CaO2所含的n(Ca2+)=![]() =0.001 33 mol
=0.001 33 mol
m(CaO)=(0.001 55 mol-0.001 33 mol)×
[

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目