题目内容
【题目】A、B、C、D四种短周期元素,0.5mol A的元素的离子得到NA个电子后被还原为中性原子;0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应;A元素原子核内质子数与中子数相等.B元素原子核外电子数比A元素原子核外电子数多1;C﹣离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层电子数的2倍.请填写下列空格:
(1)推断A、B、C、D四种元素的符号A;B;C;D;
(2)C的一价阴离子的结构示意图;
(3)D元素的最高价氧化物的结构式是;
(4)C、D两元素形成的化合物电子式 , 分子内含有键(填“极性”或“非极性”).
【答案】
(1)Mg;Al;Cl;C
(2)
(3)O=C=O
(4)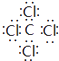 ;极性
;极性
【解析】解:短周期元素A、B、C、D中,0.5mol A元素的离子得到NA个电子被还原为中性原子,则A离子带两个单位正电荷,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,HCl的物质的量=0.1L×0.2mol/L=0.02mol,由AO+2HCl═ACl2+H2O,可知0.4gAO的物质的量为0.01mol,则M(AO)= ![]() =40g/mol,故A的摩尔质量为40g/mol﹣16g/mol=24g/mol,A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al;C﹣比A元素的离子多1个电子层,则C的质子数为18﹣1=17,即C为Cl元素;D元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,即D为C元素,(1)综上所述,A为Mg,B为Al,C为Cl,D为C,所以答案是:Mg;Al;Cl;C; (2)Cl的质子数为17,离子结构示意图为
=40g/mol,故A的摩尔质量为40g/mol﹣16g/mol=24g/mol,A原子核内质子数目与中子数目相等,则质子数为12,即A为Mg元素;B元素原子核外电子数比A元素原子核外电子数多1,则B为Al;C﹣比A元素的离子多1个电子层,则C的质子数为18﹣1=17,即C为Cl元素;D元素原子最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,即D为C元素,(1)综上所述,A为Mg,B为Al,C为Cl,D为C,所以答案是:Mg;Al;Cl;C; (2)Cl的质子数为17,离子结构示意图为 ![]() ,所以答案是:
,所以答案是:  ;(3)D为碳元素,最高价氧化物为CO2 , 分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O,所以答案是:O=C=O;(4)Cl、C两元素形成的化合物为CCl4 , 电子式为
;(3)D为碳元素,最高价氧化物为CO2 , 分子中C原子与O原子之间形成2对共用电子对,其结构式为O=C=O,所以答案是:O=C=O;(4)Cl、C两元素形成的化合物为CCl4 , 电子式为 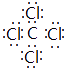 ,分子内含有极性键,所以答案是:
,分子内含有极性键,所以答案是: 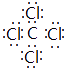 ;极性.
;极性.

 小学课时特训系列答案
小学课时特训系列答案