题目内容
【题目】反应A(g)B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L.温度T1和T2下A的浓度与时间关系如右图所示.回答下列问题: 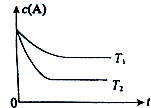
(1)上述反应的温度T1T2 , 平衡常数K(T1)K(T2).(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则: ①平衡时体系总的物质的量为 .
②反应的平衡常数K= .
③反应在0~5min区间的平均反应速率v(A)= .
【答案】
(1)小于;小于
(2)0.085mol;0.082;0.007mol/(L?min)
【解析】解:(1)由图可知T2先达平衡状态,所以T1小于T2 , 而温度越高K越小,所以正反应为吸热反应,所以温度越高K值越大,所以答案是:小于;小于;(2)
A(g) | B(g)+ | C(g) | |
起始浓度: | 0.05 | 0 | 0 |
变化浓度: | 0.035 | 0.035 | 0.035 |
平衡浓度: | 0.015 | 0.035 | 0.035 |
①平衡时体系总的物质的量为=(0.015+0.035+0.035)×1=0.085mol;②K= ![]() =0.082;③反应在0~5min区间的平均反应速率v(A)=
=0.082;③反应在0~5min区间的平均反应速率v(A)= ![]() =0.007mol/(Lmin);所以答案是:0.085mol;0.082;0.007mol/(Lmin).
=0.007mol/(Lmin);所以答案是:0.085mol;0.082;0.007mol/(Lmin).
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.

【题目】某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行滴定操作:
操作步骤:
A.在250mL容量瓶中配制250mL烧碱溶液
B.用碱式滴定管量取25.00mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
附:酸碱指示剂变色范围
指示剂 | 变色范围 | 酸色 | 碱色 |
石蕊 | 5.0﹣8.0 | 红色 | 蓝色 |
酚酞 | 8.0﹣10.0 | 无色 | 红色 |
甲基橙 | 3.1﹣4.4 | 红色 | 黄色 |
请完成下列问题:
(1)选用仪器如下:①量筒;②锥形瓶;③滴定管;④玻璃棒.上列仪器中在使用前需检查是否漏水的是 . (填序号)除以上仪器外还缺的玻璃仪器有、 .
(2)正确的操作步骤是(填写字母)→→→→ .
(3)滴定管读数应注意 .
(4)操作中锥形瓶下垫一张白纸的作用是 .
(5)操作D中液面应调整到;
(6)滴定到终点时锥形瓶内溶液的pH约为;终点时的颜色变化是 .
(7)若酸式滴定管没用标准H2SO4润洗,会对测定结果有何影响(填“偏高”、“偏低”或“无影响”,其他操作均正确).

