��Ŀ����
����[CO��NH2��2]�����������˹��ϳɵ��л��
��1����ҵ��������CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ
��2������̼��
=4��ʱCO2��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��
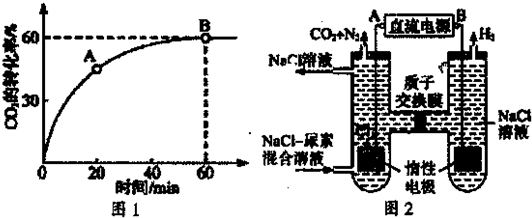
��A����淴Ӧ����v�棨CO2��
�ڷ�Ӧ�ﵽƽ���NH3��ת����Ϊ
��3���˹�����ɲ��ü�ӵ绯ѧ������ȥ��л�����е����أ�ԭ����ͼ2��
�ٵ�Դ�ĸ���Ϊ
���������з����ĵ缫��ӦΪ
�۵���������������Һ��pH����ǰ��Ƚ�
��1����ҵ��������CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ
2NH3+CO2
CO��NH2��2+H2O
| һ������ |
2NH3+CO2
CO��NH2��2+H2O
��| һ������ |
��2������̼��
| n(NH3) |
| n(CO2) |

��A����淴Ӧ����v�棨CO2��
��
��
B�������Ӧ����v����CO2�������������������=�����ڷ�Ӧ�ﵽƽ���NH3��ת����Ϊ
30%
30%
����3���˹�����ɲ��ü�ӵ绯ѧ������ȥ��л�����е����أ�ԭ����ͼ2��
�ٵ�Դ�ĸ���Ϊ
B
B
���A����B���������������з����ĵ缫��ӦΪ
2Cl--2e-=Cl2��
2Cl--2e-=Cl2��
�����û�ѧ����ʽ������ȥ���صĹ���CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl
CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl
���۵���������������Һ��pH����ǰ��Ƚ�
����
����
����������С�����䡱�������������ռ�������13.44L����״���������ȥ������Ϊ7.2
7.2
g������������ܽ⣩����������1�����ݷ�Ӧ����������������غ㶨����д��ѧ����ʽ��
��2������CO2��ת������ʱ��仯ͼ��֪����A��ʱ��Ӧ��δ�ﵽƽ��״̬����Ӧ�Խ�����������У�
����������ʽ�����㣻
��3���ٵ��ص��������ӵ�Դ�ĸ��������ݵ������жϣ�
���������з����ķ�Ӧ����Ϊ��2Cl--2e-=Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
�۸��ݵ缫����ʽ���㣬�йط�Ӧ��Ϊ������ӦΪ��6H2O+6e-=6OH-+3H2������6H++6e-=3H2����
������ӦΪ��6Cl--6e-=3Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
��2������CO2��ת������ʱ��仯ͼ��֪����A��ʱ��Ӧ��δ�ﵽƽ��״̬����Ӧ�Խ�����������У�
����������ʽ�����㣻
��3���ٵ��ص��������ӵ�Դ�ĸ��������ݵ������жϣ�
���������з����ķ�Ӧ����Ϊ��2Cl--2e-=Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
�۸��ݵ缫����ʽ���㣬�йط�Ӧ��Ϊ������ӦΪ��6H2O+6e-=6OH-+3H2������6H++6e-=3H2����
������ӦΪ��6Cl--6e-=3Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
����⣺��1��������ѧ֪ʶ����д��CO2��NH3�ϳ�CO��NH2��2�Ļ�ѧ����ʽΪ��2NH3+CO2
CO��NH2��2+H2O��
�ʴ�Ϊ��2NH3+CO2
CO��NH2��2+H2O��
��2������CO2��ת������ʱ��仯ͼ��֪����A��ʱ��Ӧ��δ�ﵽƽ��״̬����Ӧ�Խ�����������У���v����CO2��С��B��ƽ��ʱ�Ļ�ѧ��Ӧ���ʣ��ʴ�Ϊ��С�ڣ�
����CO2�ij�ʼ���ʵ���Ϊa����NH3�ij�ʼ���ʵ���Ϊ4a��
2NH3+CO2
CO��NH2��2+H2O
��ʼ/mol 4a a
ת��/mol 1.2a 0.6a
ƽ��/mol 2.8a 0.4a
ƽ��ʱNH3ת����Ϊ��
��100%=30%��
�ʴ�Ϊ��30%��
��3���ٸ��ݵ������������������ŵ���������������ŵ�Ĺ��ɼ�����ͼ�еĵ缫����H2��Cl2�������жϳ�AΪ��Դ��������BΪ��Դ�ĸ������ʴ�Ϊ��B��
���������ȷ���������Ӧ�������������������ط�Ӧ���ɵ�����������̼���Ȼ��⣬�������з����ķ�Ӧ����Ϊ��2Cl--2e-=Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
�ʴ�Ϊ��2Cl--2e-=Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
��������ӦΪ��6H2O+6e-=6OH-+3H2������6H++6e-=3H2����
������ӦΪ��6Cl--6e-=3Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
����������Ӧʽ���Կ��������������ϲ�����OH-��H+����Ŀ��ȣ��������з�Ӧ������H+ͨ�����ӽ���Ĥ������������
OH-ǡ�÷�Ӧ����ˮ�������������е��ǰ����Һ��pH���䣻��������Ӧʽ���Կ�����ת��6mole-ʱ����������3molH2����������1molN2��1molCO2���ʵ���ռ�����13.44 L�����У�V��N2��=V��CO2��=
=2.688L��
��n��N2��=n��CO2��=0.12 mol�����ݷ���ʽCO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��֪����0.12 mol N2�����ĵ�CO��NH2��2�����ʵ���ҲΪ0.12 mol��������Ϊ��m[CO��NH2��2]=0.12 mol��60 g?mol-1=7.2 g��
�ʴ�Ϊ�����䣻7.2��
| һ������ |
�ʴ�Ϊ��2NH3+CO2
| һ������ |
��2������CO2��ת������ʱ��仯ͼ��֪����A��ʱ��Ӧ��δ�ﵽƽ��״̬����Ӧ�Խ�����������У���v����CO2��С��B��ƽ��ʱ�Ļ�ѧ��Ӧ���ʣ��ʴ�Ϊ��С�ڣ�
����CO2�ij�ʼ���ʵ���Ϊa����NH3�ij�ʼ���ʵ���Ϊ4a��
2NH3+CO2
| һ������ |
��ʼ/mol 4a a
ת��/mol 1.2a 0.6a
ƽ��/mol 2.8a 0.4a
ƽ��ʱNH3ת����Ϊ��
| 1.2a |
| 4a |
�ʴ�Ϊ��30%��
��3���ٸ��ݵ������������������ŵ���������������ŵ�Ĺ��ɼ�����ͼ�еĵ缫����H2��Cl2�������жϳ�AΪ��Դ��������BΪ��Դ�ĸ������ʴ�Ϊ��B��
���������ȷ���������Ӧ�������������������ط�Ӧ���ɵ�����������̼���Ȼ��⣬�������з����ķ�Ӧ����Ϊ��2Cl--2e-=Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
�ʴ�Ϊ��2Cl--2e-=Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
��������ӦΪ��6H2O+6e-=6OH-+3H2������6H++6e-=3H2����
������ӦΪ��6Cl--6e-=3Cl2����CO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��
����������Ӧʽ���Կ��������������ϲ�����OH-��H+����Ŀ��ȣ��������з�Ӧ������H+ͨ�����ӽ���Ĥ������������
OH-ǡ�÷�Ӧ����ˮ�������������е��ǰ����Һ��pH���䣻��������Ӧʽ���Կ�����ת��6mole-ʱ����������3molH2����������1molN2��1molCO2���ʵ���ռ�����13.44 L�����У�V��N2��=V��CO2��=
| 13.44L |
| 5 |
��n��N2��=n��CO2��=0.12 mol�����ݷ���ʽCO��NH2��2+3Cl2+H2O=N2+CO2+6HCl��֪����0.12 mol N2�����ĵ�CO��NH2��2�����ʵ���ҲΪ0.12 mol��������Ϊ��m[CO��NH2��2]=0.12 mol��60 g?mol-1=7.2 g��
�ʴ�Ϊ�����䣻7.2��
���������⿼���˻�ѧƽ�⼰���ԭ��֪ʶ��������ѧƽ��Ľ������������缫������жϡ����ԭ������Ӧ�õȣ������ԭ������ʱ������Ҫע���������ϣ�����������Ϊ��Au��Pt֮��Ľ�����������������ʧȥ���ӣ�����������Ϊ���Ե缫�����������ӵķŵ�˳������������ӵķŵ�˳���ǽ���Ĺؼ���

��ϰ��ϵ�д�
 ��У����ϵ�д�
��У����ϵ�д�
�����Ŀ


 ���׳ơ����������������������谷���������ᣨ
���׳ơ����������������������谷���������ᣨ 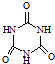 �������������������谷�����֮��ͨ��
�������������������谷�����֮��ͨ�� �̷����壨FeSO4?7H2O����ҽҩ������Ѫ����ijͬѧ��KMnO4��Һ�ζ��̷����壨FeSO4?7H2O����Ʒ�����ʲ��� KMnO4��Ӧ��������Ԫ�غ������вⶨ��
�̷����壨FeSO4?7H2O����ҽҩ������Ѫ����ijͬѧ��KMnO4��Һ�ζ��̷����壨FeSO4?7H2O����Ʒ�����ʲ��� KMnO4��Ӧ��������Ԫ�غ������вⶨ��