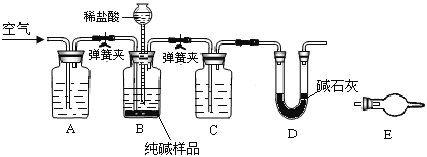
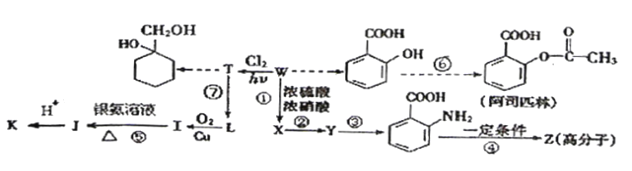
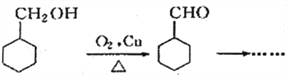
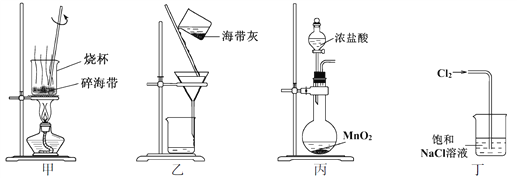
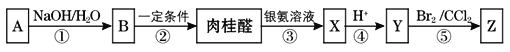
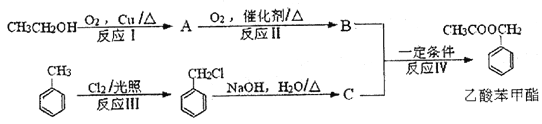
题目内容
【题目】A、B、C、D、E、F、G为原子序数依次增大的前四周期元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级。且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对。E与F同周期;G的原子序数等于A、C、D、F四种元素原子序数之和。
(1)写出B的基态原子的核外电子排布图________;回答E与F原子的第一电离能的大小关系怎样______________。原因是_____________________________________;
(2)C3-是一种弱酸根离子,请写出两种与C3-互为等电子体的分子的化学式_______,________;
(3)A与D形成的A2D2分子中D原子的杂化类型为_________杂化,A与C形成的最简单分子易溶于水的原因____________________________;
(4)G的晶体中原子按_________(填“ABABAB”或“ABCABCABC”)的方式堆积而成,G的晶体堆积模型名称______________________;
(5)G的晶体中G原子的配位数为_________,空间利用率为__________________;
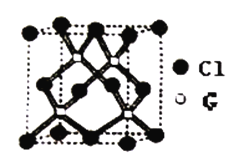
(6)元素G的一种氯化物的晶胞如图所示,该氯化物的化学式,两种微粒间最短距离为460.0pm,晶体密度为________g/cm3。(列式表示)
 .
.
【答案】 ![]() 由于镁的3s轨道电子处于全充满状态,稳定性强,则镁的第一电离能大于铝的第一电离能 N2O CO2 sp3 氨气分子能与水分子形成氢键,且氨水是极性分子,水也是极性分子,因此氨气易溶在水中 ABCABCABC 面心立方最密堆积 12 74% CuCl
由于镁的3s轨道电子处于全充满状态,稳定性强,则镁的第一电离能大于铝的第一电离能 N2O CO2 sp3 氨气分子能与水分子形成氢键,且氨水是极性分子,水也是极性分子,因此氨气易溶在水中 ABCABCABC 面心立方最密堆积 12 74% CuCl ![]()
【解析】试题A、B、C、D、E、F、G为原子序数依次增大的前四周期元素。A、F原子的最外层电子数均等于其周期序数,A是原子序数最小,则A是H。F原子的电子层数是A的3倍,所以F是第三周期元素,则F是Al;B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,因此B是碳元素;A与C形成的最简单分子为三角锥形,分子是氨气,所以C是氮元素;D原子p轨道上成对电子数等于未成对电子数,所以D是O;E原子核外每个原子轨道上的电子都已成对,原子序数小于铝而大于氧,则E是Mg。G的原子序数等于A、C、D、F 四种元素原子序数之和,即为1+7+8+13=29,即G是铜元素。
(1)碳元素是6号元素,则的基态原子的核外电子排布图为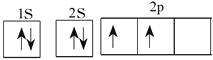 ;由于镁的3s轨道电子处于全充满状态,稳定性强,则镁的第一电离能大于铝的第一电离能。
;由于镁的3s轨道电子处于全充满状态,稳定性强,则镁的第一电离能大于铝的第一电离能。
(2)原子数和价电子数分别都相等的是等电子体,则与N3-互为等电子体的分子的化学式为N2O、CO2;
(3)A与D形成的H2O2分子中O原子形成两对共用电子对,另外还有2对孤对电子没有参与成键,所以氧原子的杂化类型为sp3杂化;由于氨气分子能与水分子形成氢键,且氨水是极性分子,水也是极性分子,因此氨气易溶在水中;
(4)铜形成的晶胞是面心立方最密堆积,所以晶体中原子按ABCABCABC的方式堆积而成;
(5)面心立方最密堆积的晶体中原子的配位数为12,空间利用率为74℅;
(6)根据元素G的一种氯化物的晶胞结构可知晶胞中含有氯原子的个是8×1/8+6×1/2=4,4个铜原子全部在晶胞中,则该氯化物的化学式CuCl;晶胞质量为![]() .Cl原子与周围的4个Cu原子形成正四面体结构,Cl原子位于正四面体的中心,Cu原子位于正四面体的顶点,设正四面体的棱长为x cm,则正四面体的斜高为
.Cl原子与周围的4个Cu原子形成正四面体结构,Cl原子位于正四面体的中心,Cu原子位于正四面体的顶点,设正四面体的棱长为x cm,则正四面体的斜高为![]() ,底面中心到边的距离为
,底面中心到边的距离为![]() ,根据正四面体的体积及中心原子与得到形成的四面体的体积关系可知正四面体的高与中心原子到底面距离之比为4:1,即中心原子到顶点与底面距离之比为3:1,则正四面体的高为
,根据正四面体的体积及中心原子与得到形成的四面体的体积关系可知正四面体的高与中心原子到底面距离之比为4:1,即中心原子到顶点与底面距离之比为3:1,则正四面体的高为![]() ,由勾股定理:
,由勾股定理:![]() ,整理的x=
,整理的x=![]() ,晶胞棱长为
,晶胞棱长为![]() ,故晶胞密度为
,故晶胞密度为
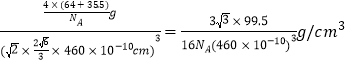 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下列关于物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | 纯碱 | 硫酸 | 小苏打 | 氧化铝 | 干冰 |
B | 苛性钠 | 盐酸 | 食盐 | 氧化钠 | 一氧化碳 |
C | 熟石灰 | 冰醋酸(CH3COOH) | 胆矾CuSO4·5H2O | 三氧化硫 | 二氧化硫 |
D | 苛性钾 | HNO3 | 碳酸钙 | 生石灰 | SO3 |
A.AB.BC.CD.D