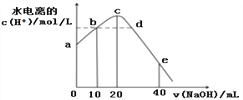
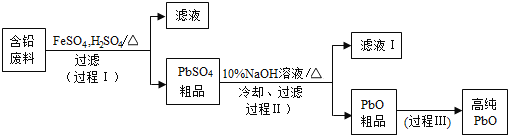
题目内容
【题目】“嫦娥一号”探月成功,实现了中国人奔月的梦想
(1)“嫦娥一号”使用的推进剂是液氢和液氧,这种推进剂的优点除产生的热量大之外,还具有的优点是_______________________。
(2)下列是298K时,氢气(H2)、碳(C)、辛烷(C8H18)、甲烷(CH4)燃烧的热化学方程式:
H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ/mol
C(g)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l) ΔH=-5518 kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol
相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是________________。
(3)已知:H2(g)=H2(l) ΔH=-0.92 kJ/mol
O2(g)=O2(l) ΔH=-6.84 kJ/mol
H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
请写出液氢和液氧生成气态水的热化学方程式_______________。如果此次“嫦娥一号”所携带的燃料为1.08吨,液氢、液氧恰好完全反应生成气态水,总共释放能量___________kJ(保留3位有效数字)。
(4)氢气、氧气不仅燃烧时能释放热能,二者形成的原电池还能提供电能,美国的探月飞船“阿波罗号”使用的就是氢氧燃料电池,电解液为KOH溶液,其电池反应为:负极放电的物质为__________________,正极:__________________,总反应式:__________________。
【答案】(1)产物为水,无污染 (2)H2
(3) H2(l)+1/2O2(I)=H2O(g) ΔH=-237.5kJ/mol 1.42×107
(4) H2 O2+2H2O+4e-=4OH- O2+2H2=2H2O
【解析】
试题分析:(1)液氢和液氧反应生成水,产物无污染,氢气燃烧放出大量的热量,故答案为:氢气放出的热量多;产物为水,无污染;
(2)设质量都为m,相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量分别是m/2×285.8kJ、m/12×393.5kJ、m/114×5518kJ、m/16×890.3kJ,最大值应为m/2×285.8kJ,因此相同质量的H2、C、C8H18、CH4完全燃烧时,放出热量最多的是H2;
(3)①H2(g)═H2(l)△H=-0.92kJ/mol
②O2(g)═O2(l)△H=-6.84kJ/mol
③H2O(l)═H2O(g)△H=+44.0kJ/mol
液氢和液氧生成气态水的热化学方程式:H2(l)+1/2O2(l)═H2O(g)△H,
根据盖斯定律,③-①-1/2×②得热化学方程式为H2(l)+1/2O2(l)═H2O(g)△H=-237.5kJ/mol;
根据质量守恒定律,液氢、液氧恰好完全时生成气态水为1.08吨,n(H2O)=![]() =6×104mol,总共释放能量Q=6×104mol×237.5kJ≈1.43×107kJ;
=6×104mol,总共释放能量Q=6×104mol×237.5kJ≈1.43×107kJ;
(4)负极的反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O;正极上是氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-,总电极反应式为O2+2H2=2H2O。

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】1 000mL某待测液中除含有0.2mol,L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):
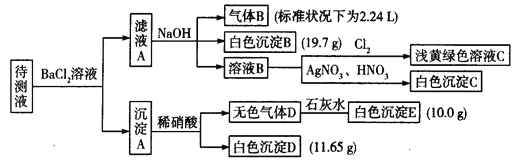
(1)写出生成白色沉淀B的离子方程式:__________________
(2)待测液中肯定不存在的阳离子是____________。
(3)若无色气体D是单一气体:
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/mol.L — | ____ | ____ | ____ | ____ | ____ | ____ |
将阴离子的物质的量浓度填入上表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:______________
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是______________。
②沉淀A中能与稀硝酸反应的成分是_______________(写化学式)。