题目内容
【题目】1 000mL某待测液中除含有0.2mol,L-1的Na+外,还可能含有下列离子中的一种或多种:
阳离子 | K+、NH4+、Fe3+、Ba2+ |
阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):
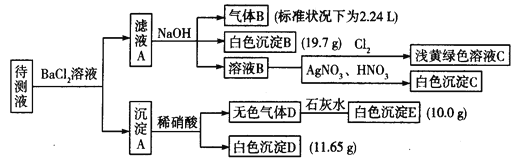
(1)写出生成白色沉淀B的离子方程式:__________________
(2)待测液中肯定不存在的阳离子是____________。
(3)若无色气体D是单一气体:
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/mol.L — | ____ | ____ | ____ | ____ | ____ | ____ |
将阴离子的物质的量浓度填入上表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:______________
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是______________。
②沉淀A中能与稀硝酸反应的成分是_______________(写化学式)。
【答案】HCO3-+Ba2++OH-=BaCO3↓+H2OFe3+、Ba2+?00.10.100.05根据电荷守恒,c(K+)最小浓度是(0.4-0.3)mol·L-1=0.1mol·L-1;因此:存在;K+离子最小浓度为0.1mol·L-1;CO32-、HCO3-、SO32-BaCO3、BaSO3。
【解析】待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;
滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中通入氯气,得浅黄绿色溶液,溶液中一定没有Br-,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-;
(1)由上述分析可知,白色沉淀B为碳酸钡,是由HCO3-、Ba2+、OH-反应生成,反应离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O;
(2)由上述分析可知,溶液中一定没有的阳离子是:Fe3+、Ba2+;
(3)①由上述分析可知,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-.
若无色气体D是单一气体,则D为CO2,E为CaCO3,溶液中含有CO32-,白色沉淀D只能为BaSO4,溶液中一定没有SO32-,一定含有SO42-;
B(碳酸钡)的物质的量=![]() =0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=
=0.1mol,则n(HCO3-)=0.1mol,故c(HCO3-)=![]() =0.1mol/L,
=0.1mol/L,
E(碳酸钙)的物质的量=![]() =0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=
=0.1mol,则n(CO32-)=0.1mol,故c(CO32-)=
![]() =0.1mol/L,
=0.1mol/L,
D(硫酸钡)的物质的量=![]() =0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=
=0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=![]() =0.05mol/L,
=0.05mol/L,
故答案为:
阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
浓度/molL-1 | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |
②n(NH4+)=n(NH3)=![]() =0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L-0.3mol.L=0.1mol/L;
=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L-0.3mol.L=0.1mol/L;
(4)由上述分析可知,溶液中一定含有CO32-、HCO3-,不能确定原溶液中是否含有Cl-,溶液中一定没有Br-;
若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,沉淀A中一定含有BaCO3,BaSO3,
①待测液中一定含有的阴离子是CO32-、HCO3-、SO32-;
②沉淀A中BaCO3,BaSO3能与稀硝酸反应。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案